Сирћетна киселина: хемијска формула, својства и примена
Етаноична киселина је боље позната као сирћетна киселина. Она представља органско једињење са формулом ЦХ3ЦООХ. Спада у класу карбоксилних киселина, чији молекули садрже функционалне моновалентне карбоксилне групе ЦООХ (или једну или више). О томе можете дати много информација, али сада пажњу треба обратити на најзанимљивије чињенице.
Формула
Како то изгледа може се схватити на слици испод. Хемијска формула сирћетне киселине је једноставна. То је због многих: само једињење је монобазно и припада карбоксилној групи, коју карактерише лако протонско цепање (стабилна елементарна честица). Ово једињење је типичан представник карбоксилних киселина, пошто има сва њихова својства.
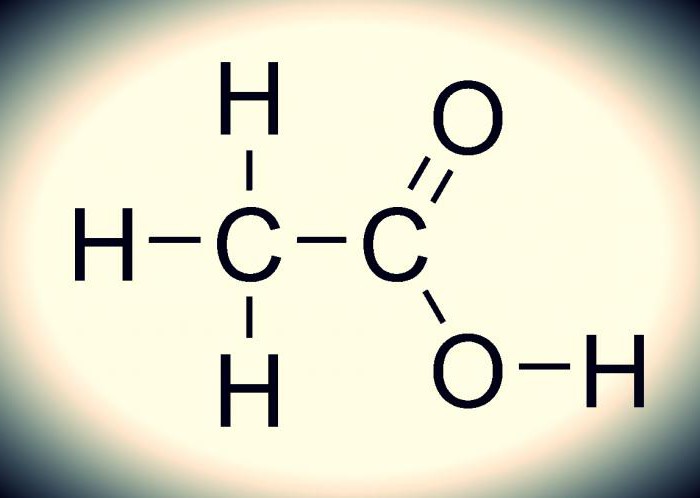
Веза између кисеоника и водоника (-ЦООХ) је високо поларна. Ово проузрокује лак процес дисоцијације (растварања, распадања) ових једињења и испољавање њихових киселинских својстава.
Као резултат, формирају се протон Х + и ацетатни јон ЦХ3ЦОО. Које су то супстанце? Ацетатни јон је лиганд повезан са специфичним акцептором (објект који прима нешто од донора), формирајући стабилне ацетатне комплексе са катионима многих метала. И протон је, као што је горе поменуто, честица способна да ухвати електрон од М-, К- или Л-електронских омотача атома.
Квалитативна анализа
Заснива се управо на дисоцијацији сирћетне киселине. Квалитативна анализа, која се назива и реакција, је комбинација физичких и хемијских метода које се користе за откривање спојева, радикала (независних молекула и атома) и елемената (комбинација честица) који чине аналит.
Користећи ову методу могуће је детектовати соли сирћетне киселине. Све изгледа не тако тешко као што се чини. У отопину се додаје јака киселина. сумпоран, на пример. А ако има мирис сирћетне киселине, онда је његова сол присутна у раствору. Како функционише? Остаци сирћетне киселине, који се формирају из соли, везани су у том тренутку са водоничним катионима из сумпорне киселине. Какав је резултат? Појава већег броја молекула сирћетне киселине. Дошло је до дисоцијације.
Реакције
Треба напоменути да је речено једињење способно за интеракцију са активним металима. То су литијум, натријум, калијум, рубидијум, францијум, магнезијум, цезијум. Ово друго је, иначе, најактивније. Шта се дешава у време таквих реакција? Водоник се развија и настаје формирање ноторних ацетата. Овде се налази хемијска формула сирћетне киселине која реагује са магнезијумом: Мг + 2ЦХ3ЦООХ → (ЦХ3ЦОО) 2 Мг + Х2.

Постоје начини за добијање дихлороацетатних (ЦХЦл2ЦООХ) и трихлороацетатних (ЦЦл3ЦООХ) киселина. У њима су атоми водоника метил групе замењени хлорним. Постоје само два начина да се то постигне. Једна је хидролиза трихлоретилена. И то је мање уобичајено од другог, базирано на способности оцтене киселине да буде хлорисана дејством гаса хлора. Овај метод је једноставнији и ефикаснији.
Ево како овај процес изгледа као хемијска формула сирћетне киселине у интеракцији са хлором: ЦХ3ЦООХ + Цл2 → ЦХ2ЦЛЦООХ + ХЦЛ. Једино је вредно разјаснити једну ствар: ово је једноставно хлорооцтена киселина, два наведена горе су формирана уз учешће црвеног фосфора у малим количинама.
Друге трансформације
Вреди напоменути да сирћетна киселина (ЦХ3ЦООХ) може да уђе у све реакције које су карактеристичне за ноторну карбоксилну групу. Може се вратити у етанол, монохидрични алкохол. Да би се то постигло, неопходно је да се на њега делује литијум алуминијум хидридом, неорганским једињењем које је снажан редукциони агенс који се често користи у органској синтези. Његова формула је Ли (АлХ 4 ).

Сирћетна киселина се такође може претворити у киселински хлорид, активни агенс за ациловање. Ово се дешава под утицајем тионил хлорида. Иначе, то је хлорид сумпорне киселине. Његова формула је Х2С03. Такође треба напоменути да се натријумова со сирћетне киселине декарбоксилира када се загрева са алкалијама (искључује се молекул угљен-диоксида), због чега настаје метан (ЦХ2). А он је, као што знате, најједноставнији угљоводоник, који је лакши од ваздуха.
Кристализација
Ледена сирћетна киселина - често је речено једињење. Чињеница је да када се охлади на само 15-16 ° Ц, прелази у кристално стање, као да се смрзава. Визуално, ово је стварно слично леду. Ако постоји неколико састојака, можете провести експеримент, а резултат ће бити трансформација оцтене киселине у лед. Једноставно је. Из воде и леда потребно је припремити расхладну смјесу, а затим спустити претходно припремљену цијев са оцтеном киселином. После неколико минута кристализује. Поред једињења, потребна је и чаша, статив, термометар и епрувета.
Штетна супстанца
Сирћетна киселина, чија хемијска формула и својства су наведена горе, је несигурна. Њени парови иритирају слузокожу горњег респираторног тракта. Праг за перцепцију мириса овог једињења у ваздуху је око 0,4 мг / л. Али постоји и концепт максимално дозвољене концентрације - санитарни и хигијенски стандард, одобрен законом. Према његовим ријечима, у зраку може бити и до 0,06 мг / м³ ове супстанце. А када се ради о радним просторијама, граница се повећава на 5 мг / м 3 .

Разорни ефекат киселине на биолошка ткива директно зависи од тога колико је разређен са водом. Најопаснија раствора са садржајем ове супстанце више од 30%. А ако особа случајно дође у контакт са концентрисаним једињењем, он неће моћи да избегне хемијске опекотине. Ово категорички не може бити дозвољено, пошто се након ове коагулационе некрозе почиње развијати - смрт биолошких ткива. Смртоносна доза је само 20 мл.
Последице
Логично је да што је већа концентрација сирћетне киселине, то ће више штетити у случају контакта са кожом или у телу. Уобичајени симптоми тровања укључују:
- Ацидосис Ацид-базни баланс се помера ка повећању киселости.
- Крвни угрушци и њихово згрушавање.
- Хемолиза еритроцита, њихово уништавање.
- Оштећење јетре.
- Хемоглобинурија. У урину се појављује хемоглобин.
- Акутна бубрежна инсуфицијенција.
- Токсични опекотински шок.
Степени озбиљности
Уобичајено је издвојити три:
- Лако Одликује се малим опекотинама једњака и уста. Али нема згрушавања крви и унутрашњи органи настављају нормално да функционишу.
- Просек. Постоји интоксикација, шок и задебљање крви. Стомак је погођен.
- Хеави Горњи респираторни тракт, зидови дигестивног тракта су озбиљно погођени, а долази до оштећења бубрега. Максимални болни шок. Можда развој опекотине.

Могуће је и тровање паром оцтене киселине. Прати га озбиљан цурење из носа, кашљање и кидање.
Помоћ
Ако је особа отрована оцтеном киселином, врло је важно брзо дјеловати како би се смањиле посљедице онога што се догодило. Размотрите шта треба да урадите:
- Исперите уста. Не гутајте воду.
- Направите испирање желуца. Потребно је 8-10 литара хладне воде. Чак и примеса крви није контраиндикација. Зато што у првим сатима тровања велики бродови и даље остају нетакнути. Тако да неће бити опасног крварења. Пре прања, аналгетици треба да буду аналгетици. Сонда је подмазана вазелинским уљем.
- Не изазивати повраћање! Неутрализовати супстанцу може се спалити магнезијум или лек "Алмагел".
- Ништа од наведеног? Затим жртва добија лед и сунцокретово уље - морате узети неколико гутљаја.
- Дозвољена је употреба погођене мешавине млека и јаја.
Важно је пружити прву помоћ у року од два сата након инцидента. После овог периода слузокоже се набубри и биће тешко смањити бол особе. И да, ни у ком случају не може се користити сода. Комбинација киселине и алкалија ће дати реакцију, током које ће се развити угљен диоксид и воде. И таква формација у стомаку може бити фатална.
Апплицатион
Водени раствори етаноичне киселине се широко користе у прехрамбеној индустрији. Ово су сирће. Да би се добила, киселина се разблажује са водом да се добије 3-15% раствор. Као адитив, означени су са Е260. Винарије су дио разних умака, а користе се и за конзервирање производа, конзервирање меса и рибе. У свакодневном животу, они су широко применљиви за уклањање каменца, мрља од одеће и прибора. Оцат је одличан дезинфицијенс. Могу да се носе са било којом површином. Понекад се додаје приликом прања да би се омекшала одећа.

Такође, сирће се примењује у припреми мирисних супстанци, лекова, растварача, у производњи ацетона и целулозног ацетата, на пример. Да, и сирћетна киселина је директно укључена у бојење и типографију.
Поред тога, користи се као реакциона средина за оксидацију разних органских супстанци. Пример из индустрије је оксидација пара-ксилена (ароматичног угљоводоника) атмосферским кисеоником у терефталну ароматичну киселину. Успут, пошто паре ове супстанце имају оштар иритантан мирис, може се користити као замена амонијака за уклањање особе из несвестице.
Синтетичка сирћетна киселина
То је запаљива течност која спада у супстанце треће класе опасности. Користи се у индустрији. Приликом рада с њим користи се особна заштитна опрема. Чувајте ову супстанцу у посебним условима и само у одређеној посуди. Обично је ово:
- чисте жељезничке цистерне;
- контејнери;
- цистерне, бурад, резервоари од нерђајућег челика (капацитет до 275 дм 3 );
- стаклене боце;
- полиетиленске бурад капацитета до 50 дм 3 ;
- затворени резервоари од нерђајућег челика.

Ако се течност складишти у контејнеру од полимера, онда је то највише месец дана. Такође, категорички није дозвољено да се ова супстанца складишти заједно са таквим јаким оксидационим средствима као што су калијум перманганат, сумпор и нитратна киселина.
Састав сирћета
И о њему треба рећи неколико ријечи. Састав традиционалног, уобичајеног сирћета укључује следеће киселине:
- Аппле Формула: НООРСН₂ЦХ (ХЕ) ЦООХ. То је уобичајен прехрамбени адитив (Е296) природног поријекла. Садржи незреле јабуке, малине, пепео, жутицу и грожђе. У дувану и дувану су представљене у облику никотинских соли.
- Млечни. Формула: ЦХ2ЦХ (ОХ) ЦООХ. Формирана током разградње глукозе. Додатак храни (Е270), који се добија млечном ферментацијом.
- Асцорбиц Формула: Ц₆Х₈О₆. Додатак храни (Е300), који се користи као антиоксидант који спречава оксидацију производа.
И наравно, етан је такође укључен у сирће - то је основа овог производа.
Како разблажити?
Ово је често постављано питање. Сви су видели продају 70% сирћетне киселине. Купује се ради припреме смеша за популарни третман, или за употребу као зачина, маринада, адитива у сосу или ролл-ин. Али не можете користити тако моћан концентрат. Стога се поставља питање како разриједити оцтену киселину до оцта. Прво морате заштитити себе - носите рукавице. Онда треба припремити чисту воду. За растворе различитих концентрација биће потребна одређена количина течности. Који Погледајте табелу испод и разблажите сирћетну киселину у односу на податке.
Концентрација вина | Почетна концентрација сирћета 70% |
30 | 1: 1.5 (однос је један део сирћета до н-тог дела воде) |
10 | 1: 6 |
9 | 1: 7 |
8 | 1: 8 |
7 | 1: 9 |
6 | 1:11 |
5 | 1:13 |
4 | 1:17 |
3 | 1:22 |
У принципу, ништа компликовано. Да бисте добили 9% раствор, потребно је да узмете количину воде у милилитрима користећи ову формулу: 100 грама сирћета помножено са почетном стопом (70%) и подељено са 9. Шта се дешава? Бројка је 778. Из овога се одузима 100, пошто је изворно узето 100 грама киселине. Испада 668 милилитара воде. Ова количина се помеша са 100 г сирћета. Резултат је цела боца од 9 процената.
Иако, можете се понашати још лакше. Многи су заинтересовани за прављење сирћета из сирћетне киселине. Еаси! Главно је запамтити да је за један део 70% раствора потребно узети 7 делова воде.