Енталпија - шта је то?
Која је енталпија стварања супстанци? Како користити ову вриједност у термокемији? Да би пронашли одговоре на ова питања, размотрите основне термине који се односе на топлотни ефекат хемијске интеракције.
Термички ефекат реакције
То је количина која карактеризира количина топлоте ослобођени или апсорбовани током интеракције супстанци.
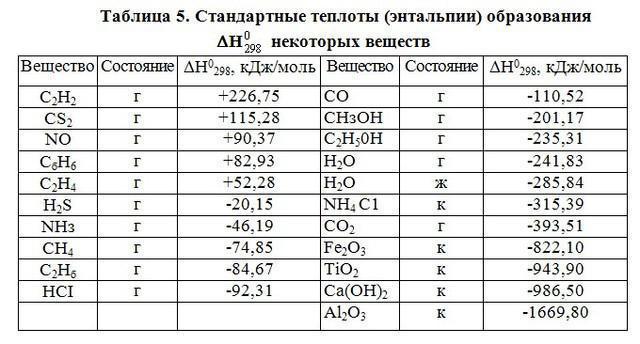
Ако се процес одвија под стандардним условима, топлотни ефекат се назива стандардним ефектом реакције. Ово је стандардна енталпија формирања продуката реакције.
Капацитет грејања процеса
То је физичка количина која одређује однос мале количине топлоте и промене температуре. Ј / К се користи као јединица за мерење топлотног капацитета.
Специфична топлота назвати количину топлотне енергије која је потребна за повећање степена температуре на скали Целзијуса за тело које има масу од једног килограма.
Термокемијски ефекат
За скоро све хемијска реакција Можете израчунати количину енергије која се апсорбује или ослобађа током интеракције хемијских компоненти.
Такве трансформације се називају егзотермне, због чега се одређена количина топлоте ослобађа у атмосферу. На пример, процесе повезивања карактерише позитиван ефекат.
Енталпија реакције се израчунава узимајући у обзир састав супстанце, као и стереохемијске коефицијенте. Ендотермне интеракције укључују апсорпцију одређене количине топлоте како би се започела хемијска реакција.
Стандардна енталпија је вредност која се користи у термокемији.
Спонтани процес
Ин термодинамички систем процес спонтано наставља када се слободна енергија интеракционог система смањи. Као услов за постизање термодинамичке равнотеже, разматрамо минималну вредност термодинамичког потенцијала.
Само ако се константни вањски увјети очувају у времену, можемо говорити о инваријантности интеракције.
Једна од секција термодинамике проучава тачно равнотежна стања у којима је енталпија израчуната за сваки појединачни процес.
Хемијски процеси су реверзибилни у случајевима када се јављају истовремено у два обрнута правца: обрнути и напред. Ако се обрнути процес посматра у затвореном систему, онда ће у одређеном временском периоду систем достићи стање равнотеже. Карактерише га престанак промена у концентрацији свих супстанци у времену. Такво стање не значи потпуно престанак реакције између полазних материјала, јер је равнотежа динамички процес.
Енталпија је физичка количина која се може израчунати за различите хемикалије. Квантитативна карактеристика равнотежног процеса је константа равнотеже, изражена као парцијални притисак, равнотежне концентрације и молске фракције интерактивних супстанци.
За било који реверзибилни процес, може се израчунати константа равнотеже. Зависи од температуре, као и од природе компоненти које делују.
Размотримо пример појаве равнотежног стања у систему. У почетном тренутку у систему постоје само почетне супстанце А и Б. Брзина директне реакције има максималну вредност, а обрнути процес се не наставља. Како се концентрација почетних компоненти смањује, уочава се повећање брзине обрнутог процеса.
С обзиром да је енталпија физичка величина која се може израчунати за реактанте, као и за производе процеса, могу се направити одређени закључци.
После одређеног временског интервала, брзина директног процеса је једнака брзини обрнуте интеракције. Константа равнотеже је однос константи брзине директног и инверзног процеса. Физичко значење ове количине показује колико пута је брзина директног процеса већа од вредности обрнуте интеракције код одређене концентрације и температуре.

Утицај спољних фактора на кинетику процеса
Пошто је енталпија вредност која се користи за термодинамичке прорачуне, постоји веза између ње и услова процеса. На пример, на термодинамичку интеракцију утичу концентрација, притисак, температура. Када се једна од ових вредности промени, долази до померања равнотеже.

Енталпија је термодинамички потенцијал који карактерише стање система у равнотежи када се бира у облику независне варијабле ентропије, притиска, броја честица.
Енталпија карактерише ниво енергије који се чува у његовој молекуларној структури. Према томе, ако супстанца има енергију, она није у потпуности претворена у топлоту. Део се складишти директно у супстанци, неопходан је за функционисање супстанце на одређеном притиску и температури.

Закључак
Промена енталпије је мера топлоте хемијске реакције. Карактеризира количину енергије која је потребна за измјену топлине при константном тлаку. Ова вредност се користи у ситуацијама када су константне вредности у процесу притиска и температуре.
Енталпија се често описује као укупна енергија супстанце, јер се дефинира као сума унутрашња енергија и посао који систем ради.
У стварности, ова количина делује као укупна количина енергије, која карактерише енергетске показатеље супстанце, која се претвара у топлоту.
Овај израз је предложио Х. Камерлингх Оннес. Приликом извођења термодинамичких прорачуна у неорганској хемији, мора се узети у обзир количина твари. Прорачуни се изводе на температури која одговара 298 К, притиску од 101 кПа.
Хесов закон, који је главни параметар за модерну термокемију, омогућава нам да одредимо могућност спонтаног тока хемијског процеса, да израчунамо његов топлотни ефекат.