Угљени оксиди: хемија, разред 8
Све што нас окружује састоји се од спојева различитих хемијских елемената. Ми дишемо не само ваздух, већ и комплексно органско једињење које садржи кисеоник, азот, водоник, угљен диоксид и друге неопходне компоненте. Утицај многих од ових елемената на људски организам посебно и на живот на Земљи као целини још није у потпуности проучен. Да би се разумели процеси интеракције елемената, гасова, соли и других формација једни са другима, предмет “Хемија” је уведен у школски курс. 8. разред је почетак наставе хемије према одобреном опћем образовном програму.
Једно од најчешћих једињења у Земљиној кори иу атмосфери је оксид. Оксид је једињење било ког хемијског елемента са атомом кисеоника. Чак је и извор живота на Земљи - вода, водиков оксид. Али у овом чланку не говоримо о оксидима уопште, већ о једном од најчешћих једињења - угљен моноксиду. Ова једињења се добијају спајањем атома кисеоника и угљеника. Ова једињења могу да садрже различите количине угљеникових атома и кисеоника, међутим, треба разликовати два главна једињења угљеника са кисеоником: угљен моноксид и угљен диоксид.
Хемијска формула и метода за производњу угљен моноксида
Која је његова формула? Угљен моноксид се лако памти - ЦО. Молекул угљен моноксида је формиран троструком везом, и стога има прилично високу чврстоћу везе и има веома малу интернуклеарну удаљеност (0.1128 нм). Енергија пуцања овог хемијског једињења је 1076 кЈ / мол. Трострука веза настаје због чињенице да угљенични елемент у својој атомској структури има п-орбиталу коју не заузимају електрони. Ова околност ствара могућност да атом угљеника постане акцептор електронског пара. А атом кисеоника, напротив, има један нераспарени пар електрона на једном од п-орбитала, и зато има електрон-донорске способности. Када ова два атома комбинују, поред две ковалентне везе, појављује се и трећа - ковалентна веза донор-акцептор. 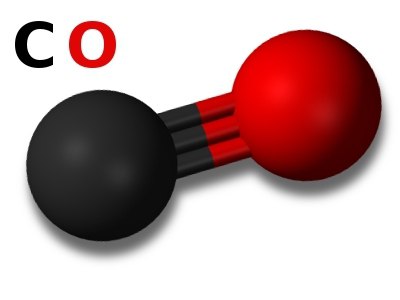
Постоје различити начини за добијање ЦО. Један од најједноставнијих је пренос угљен диоксида преко врелог угља. У лабораторијским условима, угљен моноксид се производи следећом реакцијом: мравља киселина се загрева са сумпорном киселином, која одваја мрављу киселину од воде и угљен моноксида.
ЦО се такође ослобађа када се загрева оксална киселина и сумпорна киселина.
Физичке особине ЦО
Угљен моноксид (2) има следећа физичка својства - то је безбојни гас који нема изражен мирис. Сви нежељени мириси који се јављају током цурења угљен-моноксида су производи разградње органских нечистоћа. Много је лакши од ваздуха, изузетно је токсичан, веома слабо растворљив у води и карактерише га висок степен запаљивости.
Најважније својство ЦО је његов негативан утицај на људски организам. Тровање угљен моноксидом може бити фатално. Детаљније о ефектима угљен моноксида на људско тело биће описано у наставку.
Хемијска својства ЦО
Главне хемијске реакције у којима се могу користити угљени оксиди (2) су редокс реакција као и реакција адиције. Редокс реакција се изражава у способности ЦО да редукује метал из оксида мешањем са даљим загревањем.
У интеракцији са кисеоником настаје угљен диоксид са ослобађањем значајне количине топлоте. Угљен моноксид гори плавичастим пламеном. Веома важна функција угљен моноксида је његова интеракција са металима. Као резултат таквих реакција, формирају се карбонили метала, од којих су већина кристалне супстанце. Користе се за производњу ултра-чистих метала, као и за наношење металних превлака. Иначе, карбонили имају добру репутацију као катализатори за хемијске реакције.
Хемијска формула и метода за производњу угљен диоксида
Угљен диоксид, или угљен диоксид, има хемијску формулу ЦО 2 . Структура молекула се донекле разликује од структуре ЦО. У овој формацији, угљеник има оксидационо стање +4. Структура молекула је линеарна и стога неполарна. Молекул ЦО 2 нема тако јаку снагу као ЦО. Земљина атмосфера садржи око 0,03% угљен диоксида по укупној запремини. Повећање овог индикатора уништава озонски омотач Земље. У науци се овај феномен назива ефекат стаклене баште.
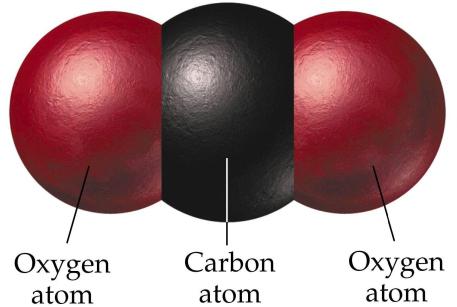
Угљен-диоксид се може добити на различите начине. У индустрији, настаје као резултат сагоревања димних гасова. То може бити нуспроизвод у процесу производње алкохола. Може се добити у процесу разлагања ваздуха у главне компоненте, као што су азот, кисеоник, аргон и други. У лабораторијским условима, угљен моноксид (4) се може добити у процесу сагоревања кречњака, а код куће се угљен-диоксид може екстраховати реакцијом лимунске киселине и соде бикарбоне. Иначе, на самом почетку производње направљена су газирана пића.
ЦО 2 Физичка својства
 Угљен диоксид је безбојна гасовита супстанца без карактеристичног јаког мириса. Захваљујући високој брзини оксидације, овај гас има благо кисели укус. Овај производ не подржава процес сагоревања, јер је и сам резултат сагоревања. Са повишеном концентрацијом угљен-диоксида, особа губи способност дисања, што је фатално. Више детаља о ефектима угљен диоксида на људско тело биће описано у наставку. ЦО 2 је много тежи од ваздуха и савршено растворљив у води, чак и на собној температури.
Угљен диоксид је безбојна гасовита супстанца без карактеристичног јаког мириса. Захваљујући високој брзини оксидације, овај гас има благо кисели укус. Овај производ не подржава процес сагоревања, јер је и сам резултат сагоревања. Са повишеном концентрацијом угљен-диоксида, особа губи способност дисања, што је фатално. Више детаља о ефектима угљен диоксида на људско тело биће описано у наставку. ЦО 2 је много тежи од ваздуха и савршено растворљив у води, чак и на собној температури.
Једно од најзанимљивијих својстава угљичног диоксида је то што нема текуће агрегатно стање при нормалном атмосферском притиску. Међутим, ако се утиче на структуру излагања угљен-диоксиду температури од -56,6 ° Ц и притиску од око 519 кПа, онда се она претвара у безбојну течност.
Уз значајно смањење температуре, гас је у стању такозваног "сувог леда" и испарава на температури већој од -78 о Ц.
Хемијска својства ЦО 2
Типична су хемијска својства угљичног моноксида (4), чија је формула ЦО 2 ацид окиде и има сва своја својства.
1. У интеракцији са водом, формира се угљена киселина која има слабу киселост и ниску стабилност у растворима.
2. У интеракцији са алкалијама, угљен диоксид формира одговарајућу со и воду.
3. За време интеракције са оксидима активног метала поспешује формирање соли.
4. Не подржава процес горења. Само одређени активни метали, као што је литијум, калијум, натријум, могу активирати овај процес.
Утицај угљен моноксида на људско тело
 Вратимо се главном проблему свих гасова - утицају на људски организам. Угљен моноксид припада групи изузетно опасних гасова. За људе и животиње, то је изузетно јака отровна супстанца која, ако се прогута, озбиљно утиче на крв, нервни систем тела и мишиће (укључујући и срце).
Вратимо се главном проблему свих гасова - утицају на људски организам. Угљен моноксид припада групи изузетно опасних гасова. За људе и животиње, то је изузетно јака отровна супстанца која, ако се прогута, озбиљно утиче на крв, нервни систем тела и мишиће (укључујући и срце).
Угљен моноксид у ваздуху се не може препознати, јер овај гас нема јасан мирис. То је оно што је он опасан. Када уђе у људско тело кроз плућа, угљен моноксид активира своју деструктивну активност у крви и почиње да ступа у интеракцију са хемоглобином стотинама пута брже од кисеоника. Као резултат, појављује се веома отпорно једињење које се назива карбоксихемоглобин. Он омета испоруку кисеоника из плућа у мишиће, што доводи до гладовања ткива у мишићима. Посебно озбиљно погођен овим мозгом.
Због немогућности препознавања тровања угљен моноксидом кроз мирис, требали бисте знати неке од главних симптома који се јављају у раним фазама:
- вртоглавица, праћена главобољом;
- тинитус и треперење пред очима;
- лупање срца и кратак дах;
- црвенило лица.
У будућности, жртва тровања појављује се тешка слабост, понекад повраћање. У тешким случајевима тровања могући су невољни напади, праћени даљим губитком свијести и комом. Ако пацијенту није пружена одговарајућа медицинска помоћ благовремено, онда је смрт могућа.
Утицај угљен диоксида на људско тело
Оксиди угљеника са киселином +4 спадају у секцију гушења гасова. Другим ријечима, угљични диоксид није отровна твар, али може значајно утјецати на проток кисика у тијело. Када се ниво угљен-диоксида повећа на 3-4%, особа постаје озбиљно слаба и почиње да спава. Када се ниво повећа на 10%, почињу да се развијају јаке главобоље, вртоглавица, оштећење слуха и понекад се примећује губитак свести. Ако се концентрација угљен-диоксида подигне на ниво од 20%, тада долази до смрти од кисиковог изгладњивања.
Третман тровањем угљен-диоксидом је веома једноставан - да жртви обезбеди приступ чистом ваздуху, ако је потребно, да уради вештачко дисање. У екстремним случајевима, морате повезати жртву са вентилатором.
Из описа утицаја ова два оксида угљеника на тело, можемо закључити да угљен моноксид, са својом високом токсичношћу и усмереним ефектима на тело изнутра, још увек представља велику опасност за људе.
Угљен-диоксид се не разликује у таквој издаји и мање је штетан за људе, стога је та супстанца која особа активно користи чак иу прехрамбеној индустрији.
Коришћење оксида угљеника у индустрији и њихов утицај на различите аспекте живота
Угљени оксиди се веома широко користе у различитим пољима. људске активности и њихов опсег је изузетно богат. На тај начин се угљен моноксид употребљава снажно и главно у металургији у процесу топљења гвожђа. ЦО је стекао широку популарност као материјал за складиштење хране у охлађеном стању. Овај оксид се користи за прераду меса и рибе како би им дао свјежи изглед и не мијењају укус. Важно је не заборавити на токсичност овог гаса и запамтити да дозвољена доза не би требала прећи 200 мг на 1 кг производа. ЦО се недавно све више користи у аутомобилској индустрији као гориво за аутомобиле на гас. 
Угљен диоксид није токсичан, тако да се његов опсег примене широко примењује у прехрамбеној индустрији, где се користи као конзерванс или прашак за пециво. ЦО 2 се користи иу производњи минералне и газиране воде. У чврстом стању ("суви лед") често се користи у постројењима за замрзавање како би се одржала стабилна ниска температура у просторији или уређају.
Угљен-диоксидни апарати за гашење пожара постали су веома популарни, пјена која потпуно изолује ватру од кисеоника и не дозвољава да се ватра запали. Према томе, друга примена је безбедност од пожара. Цилиндри у пнеуматским пиштољима су такође напуњени угљен диоксидом. И наравно, скоро сваки од нас чита од чега се састоји освјеживач зрака за собе. Да, једна од компоненти је угљен диоксид.
Као што видимо, због своје минималне токсичности, угљични диоксид је све чешћи у свакодневном животу особе, док је угљични моноксид нашао примјену у тешкој индустрији.
Постоје и друга једињења угљеника са кисеоником, а корист формуле угљеника и кисеоника дозвољава употребу различитих варијанти једињења са различитим бројем атома угљеника и кисеоника. Број оксида може варирати од Ц2О2 до Ц32О8. Да бисте описали сваку од њих, требаће вам више од једне странице.
Оксиди угљеника у природи
Обе врсте угљеникових оксида које се овде разматрају су некако присутне у природном свету. Дакле, угљен моноксид може бити производ сагоревања шума или резултат људске активности (издувни гасови и опасни отпад индустријских предузећа).
Већ познати угљен диоксид је такође део комплексне композиције ваздуха. Његов садржај је око 0,03% од укупног броја. Са повећањем овог индикатора јавља се тзв. Ефекат стаклене баште, чега се модерни научници тако плаше.  Угљендиоксид емитују животиње и људи кроз издисање. То је главни извор таквог корисног елемента за биљке као што је угљеник, због чега многи научници журе на то место, указујући на недопустивост велике сече. Ако биљке престану да апсорбују угљен диоксид, проценат његовог садржаја у ваздуху може се повећати до критичних за индикаторе људске активности.
Угљендиоксид емитују животиње и људи кроз издисање. То је главни извор таквог корисног елемента за биљке као што је угљеник, због чега многи научници журе на то место, указујући на недопустивост велике сече. Ако биљке престану да апсорбују угљен диоксид, проценат његовог садржаја у ваздуху може се повећати до критичних за индикаторе људске активности.
Очигледно је да су многи ауторитети заборавили материјал из уџбеника “Општа хемија. 8. степен, иначе би се проблему крчења шума у многим деловима света посветила већа пажња. То се, узгред, односи и на проблем присуства угљен моноксида у околини. Количина људског отпада и проценат емисије овог изузетно токсичног материјала у животну средину се повећава из дана у дан. И није чињеница да је судбина свијета, описана у прекрасном цртаном филму "Валли", када је човјечанство морало да остави Земљу заробљену до свог темеља и оде у друге свјетове у потрази за бољим животом, неће се поновити.