Како направити једнаџбу кемијске реакције: низ акција
Хајде да причамо о томе како да направимо једначину хемијске реакције. Управо то питање изазива озбиљне тешкоће за школску дјецу. Неки не могу да разумеју алгоритам за компајлирање формула производа, други погрешно постављају коефицијенте у једначини. С обзиром да се све квантитативне калкулације изводе управо помоћу једнаџби, важно је разумјети алгоритам акција. Хајде да покушамо да смислимо како да саставимо једначине хемијских реакција.
Формулисање валентних формула
Да бисте правилно записали процесе који се одвијају између различитих супстанци, морате научити како да пишете формуле. Бинарна једињења узимају у обзир валенције сваког елемента. На пример, у металима главних подгрупа, он одговара броју групе. Приликом састављања коначне формуле, између ових индикатора се одређује најмањи вишекратник, а затим се распоређују индекси.

Шта је то једначина
Под тим се подразумева симболички запис који приказује интеракцијске хемијске елементе, њихове квантитативне односе, као и оне супстанце које се добијају као резултат процеса. Један од задатака понуђених ученицима деветог разреда у завршној хемијској сертификацији је следећи текст: „Формулишите реакционе једначине које карактеришу хемијска својства предложене класе супстанци“. Да би се носили са задатком, ученици морају имати алгоритам акције.
Алгоритам акције
На пример, потребно је да напишете процес сагоревања калцијума, користећи симболе, коефицијенте, индексе. Хајде да разговарамо о томе како да направимо једнаџбу хемијске реакције, користећи процедуру. На левој страни једначине пишемо у знаке "+" са знаковима супстанце која је укључена у ову интеракцију. Пошто се сагоревање дешава уз учешће кисеоника ваздуха, који припада дијатомејским молекулима, пише се његова формула О2.
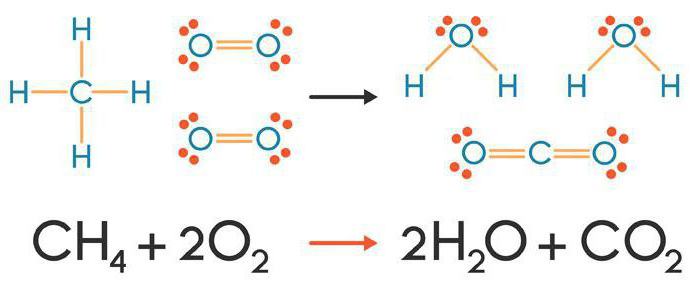
Пратећи знак једнакости, обликујемо састав реакционог производа користећи правила валентног распореда:
2Ца + О2 = 2ЦаО.
Наставак разговора о томе како направити једнаџбу хемијска реакција, Напомињемо потребу да се користи закон константности састава, као и очување састава супстанци. Они омогућавају да се изврши процес прилагођавања, да се коефицијенти који недостају у једнаџби уреде. Овај процес је један од најједноставнијих примера интеракција које се јављају у неорганској хемији.
Важни аспекти
Да бисмо разумели како да саставимо једначину хемијске реакције, забележимо нека теоретска питања која се тичу ове теме. Закон о очувању маса супстанце, које је формулисао М. В. Ломоносов, објашњава могућност расподеле коефицијената. Како број атома сваког елемента пре и после интеракције остаје непромењен, могуће је извршити математичке прорачуне.

Приликом изједначавања леве и десне стране једначине, користи се најмањи заједнички вишеструки, на исти начин као што је формулисана формулација узимајући у обзир валенције сваког елемента.
Редок интерацтионс
Након што су ученици разрадили алгоритам акција, моћи ће да направе једну једначину реакција које карактеришу хемијске особине једноставних супстанци. Сада можете прећи на анализу сложенијих интеракција, као што се дешава са променом оксидациона стања на елементима:
Фе + ЦуСО4 = ФеС04 + Цу.
Постоје одређена правила према којима се оксидациона стања постављају у једноставним и сложеним супстанцама. На пример, за дијатомејске молекуле овај индикатор је нула, у комплексним једињењима сума свих оксидационих стања такође треба да буде нула. У припреми електронског баланса одредите атоме или јоне који донирају електроне (редукцијски агенс), узмите их (оксиданс).

Између ових индикатора одређује се најмањи вишекратник, као и коефицијенти. Завршна фаза анализе редокс интеракције је расподјела коефицијената у схеми.
Јонске једначине
Једно од важних питања која се разматрају у школској хемији је интеракција између рјешења. На пример, задатак је дат на следећи начин: "Направите једначину за хемијску реакцију измене јона између баријум хлорида и натријум сулфата." То укључује писање молекуларне, комплетне, скраћене јонске једначине. Да би се размотрила интеракција на нивоу јона, неопходно је да се наведе за сваки полазни материјал, производ реакције из табеле растворљивости. На пример:
БаЦл2 + На2С04 = 2НаЦл + БаС04
Супстанце које се не растварају у јоне бележе се у молекуларном облику. Размена јона одвија се потпуно у три случаја:
- формирање седимента;
- испуштање гаса;
- производњу ниско дисоциране супстанце, на пример, воде.

Ако супстанца има стереохемијски коефицијент, то се узима у обзир приликом писања комплетне јонске једначине. Након што је написана комплетна јонска једначина, спроводи се редукција оних јона који нису везани у раствору. Коначни резултат сваког задатка који укључује разматрање процеса који се одвија између раствора комплексних супстанци биће запис о смањеној јонској реакцији.
Закључак
Хемијске једначине омогућују нам да објаснимо помоћу симбола, индекса, коефицијената оне процесе који се посматрају између супстанци. У зависности од тога који се процес одвија, постоје одређене суптилности писања једначине. Општи алгоритам за компилацију реакција, разматран горе, заснива се на валенцији, закону очувања масе супстанци, константности композиције.