Осмотски притисак у природи и људском животу
Материјал достављен у преглед ће дати информације о осмотском притиску (г). У наставку ће се разматрати: формулација појма, својства и својства, методе мјерења притиска, однос с биологијом и однос с рјешењима (пп) различитих типова.
Упознавање са осмотским притиском
Осмотски притисак је вишак хидростатског притиска на растворе. У исто време, сама раствора треба да буду одвојена полупропусним типом мембране од чистих растварача. Процес растварања дифузије кроз мембрану у таквим условима се не дешава. Сврха овог притиска је да настоји да створи једнаку равнотежу између концентрација било ког раствора, а средство је састанак молекуларне дифузије између растворене материје и растварача. Осмотски притисак је означен словом "π" (пи).
О некретнинама
Осмотски притисак има феномен тоничности, који је градијентна мера осмотског притиска. Другим речима, то је потенцијал разлике воде у пару п-јарка који је одвојен полупропусном мембраном. Хипертониц солутион именовати супстанцу која има у поређењу са другим раствором већи осмотски притисак. Супротно томе, хипотонични раствор има нижи осмотски индекс.
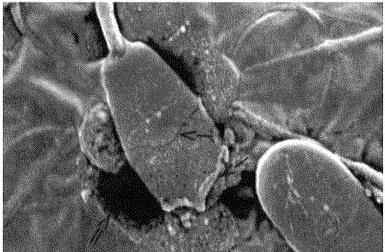
Ако се такво решење стави у затворени простор, на пример, у крвну ћелију, онда ћемо видети да осмотски притисак може да се сломи. ћелијске мембране. Лекови који се уносе у крв прво се помешају са изотоничним п-румом, што их доводи до растварања управо из тог разлога. Са овим натријум хлорид у раствору треба да се налази у количини која је у стању да уравнотежи осмотски ефекат ћелијске течности.
Ако су лекови примењеног типа направљени на бази воде или веома разређених раствора, осмотска разградња би разбила крвне ћелије тако што би приморала воду да продре у њих. Стварање решења уз коришћење превисоких концентрација супстанци ће приморати воду да напусти ћелије, и као резултат ће се смањити. За ово је довољно од три до десет процената натријум хлорида у п-ре.
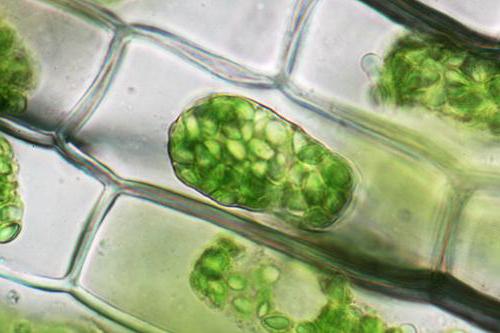
Биљне ћелије, за разлику од животиња, биће подвргнуте одвајању од ћелијског зида, свих његових садржаја, са изузетком спољашњег ћелијског зида, али заједно са мембраном. Овај феномен се назива плазмолиза. Деплазмолизом, заузврат, је процес који се посматра приликом померања смањених ћелија у пп више разблаженог типа.
Однос притиска и решења
Хемијска природа раствора у једињењу не утиче на величину осмотског ефекта. Његова брзина зависи од количине ових супстанци у п-ре. Према томе, видимо да је осмотски притисак колигативно својство отопине. Притисак ће се повећавати са повећањем концентрације активних супстанци у п-ре. На то указује закон осмотског притиска. Формула је сасвим једноставна:
π = и · Ц · Р · Т ,
где изотонични коефицијент је означено словом и , моларни ниво концентрације п-ра изражен је Ц (мол / м 3 ), универзални гасни индекс његове константе је означен словом Р, а Т је термодинамички ниво п-ра температуре.
Формула је слична закону о идеалном гасу. Честице у ваздуху перфецт гас у растворном медију вискозног типа, сличности у њиховим својствима такође указују на њихове заједничке карактеристике. Ова изјава потврђује бројне експерименте које је спровео Ј. Б. Перрин 1906. Он је посматрао процес дистрибуције емулзионих честица гуммиговој смоли у воденом ступцу, који је генерално послушао Болцманов закон.
Постоји концепт онцотичног осмотског притиска, који зависи од количине протеина у раствору. Као резултат гладовања или болести бубрега, концентрација протеина ће се смањити. Из тог разлога ће пасти онкотски притисак и почети ће се појављивати едеми онкотске природе. Доћи ће до трансфера воде из ткива у крвне судове, до оних мјеста гдје је он онк више Гнојни процеси узрокују повећање π онц два до три пута. То је због уништења протеина, што доводи до повећања броја честица.
Стабилан осмотски индекс требао би бити приближно 7,7 атм. Изотонична решења обично садрже око π плазме = 7.7 атм. Решења са π прелази π плазме , користи се за уклањање гноја из рана или за елиминисање алергијске едеме. Они су такође лаксативни лекови.
Термодинамички приказ осмотског притиска
Вант-Хофф-ова формула која се користи за осмотско лијечење може се оправдати са термодинамичког гледишта.

Слободна енергија, која је у раствору, одговара Г = Г 0 + РТлнк А + π В Ц. Моларни део раствора ће бити означен са к А , В Ц - то је индикатор моларног волумена. Термин π В Ц је еквивалентан увођењу слободне енергије спољашњег притиска. Чисти растварач има Г = Г0 . Ако индекс равнотеже Г отапала одговара индикатору 0, тада добијамо:
0 = = Г = Г 0 + РТлнк А + π В Ц - Г 0 = РТ лнк А + π В Ц.
Резултирајући запис се може претворити у ван'т Хоффову формулу.
О колоидним растворима
Осмотски притисак раствора може настати ако су присутна два услова:
- Потребна је полупропустљива преграда (мембрана).
- Присуство два раствора на обе стране мембране, док раствори морају бити различитих концентрација.
Ћелијска мембрана може проћи честице специфичних величина, на пример, примити и ослободити молекул воде, али има супротан ефекат на Ц2Х6О. Тако, користећи специјалне материјале, који такође имају такву могућност одвајања, могуће је раздвојити различите компоненте смеше.
Осмотска решења се израчунавају коришћењем π = цРТ. Ова формула је изведена Вант-Хоффом 1885. године, а Пфеферови експерименти са порозним порцуланом послужили су као основа за његово проналажење.
Тургор у кавезу
И осмоза и осмоза су веома важне компоненте многих биолошких система. Ако структура садржи полупропусни септум (специфично ткиво или ћелијски зид), константна брзина осмозе воде ће створити превише хидростатичког притиска, и као резултат ће настати тургор, који ће обезбедити снагу и отпорност ткива.
Можда феномен хемолизе, која је руптура ћелијске мембране, као што је еритроцит као резултат прекомерног бубрења када се стави у пречишћену воду.
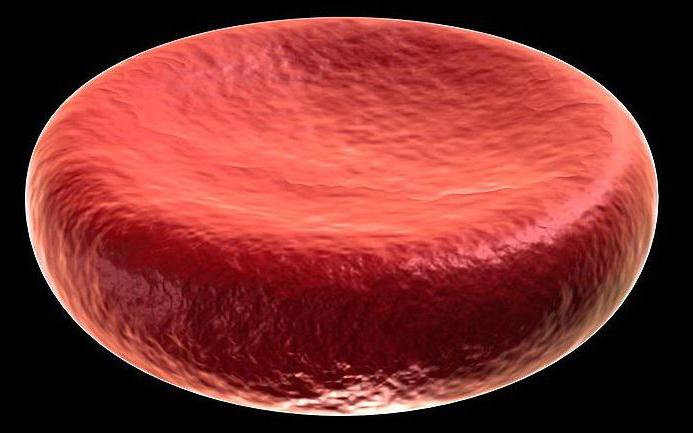
Пласмолисис
Насупротни процеси се дешавају када се ћелија постави у растворе соли концентрисаног типа: вода која се налази у ћелији дифундира у раствор соли кроз мембрану. Као резултат, ћелија ће се смањити, изгубивши свој тургор стабилног стања. Овај феномен се назива плазмолиза. Међутим, тургор се може обновити постављањем плазмолизоване ћелије у протоплазматску воду. Запремина ћелија ће се одржавати само у изотоничном п-ре са истом концентрацијом (константна осмотска).
Сумминг уп
Овај материјал је омогућио читаоцу да се упозна са концептом осмотског третмана, формулише општу идеју о томе и научи много занимљивих ствари. На пример, сличност прорачуна формуле са Ван'т Хоффовом формулом, сличност са идеалним гасом, улога у биолошким процесима и последице које они могу да изазову, тургор, плазмолиза, хемолиза и још много тога.