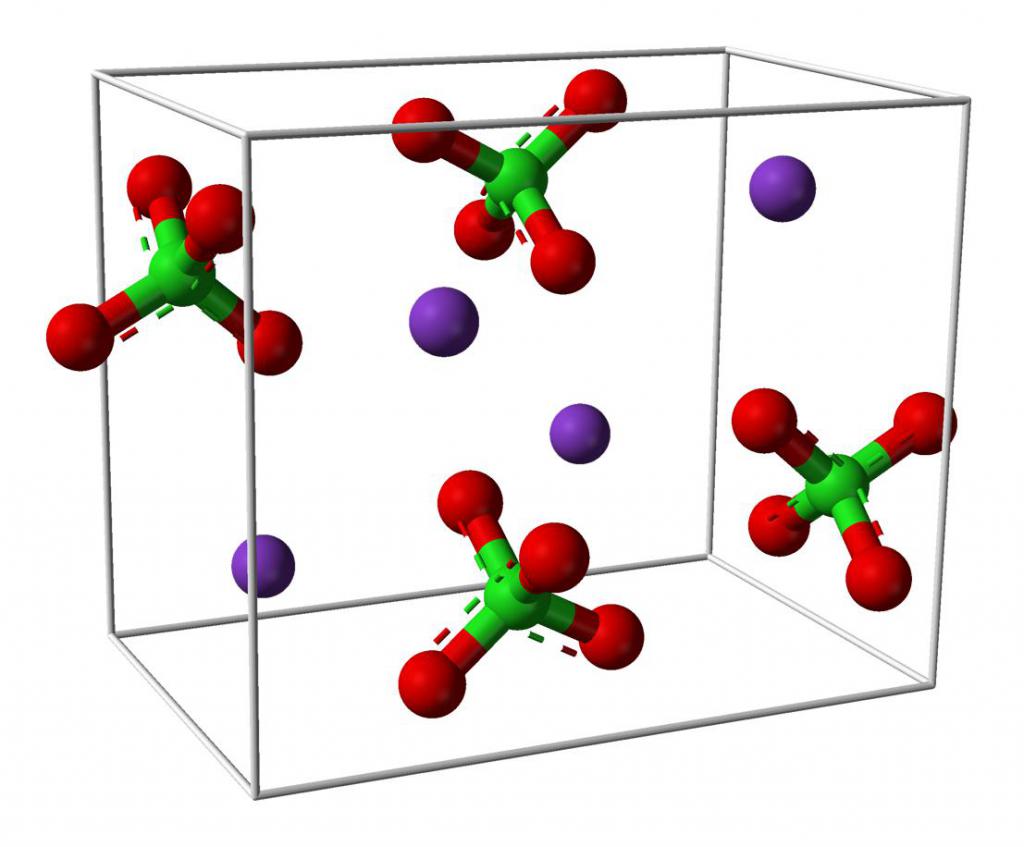
Натријум перхлорат: формула, опште информације, хемијска својства
Натријум перхлорат је безбојна кристална супстанца без мириса. Хигроскопан је и формира неколико кристалних хидрата. Са хемијске тачке гледишта, то је натријумова со перхлорне киселине. Није запаљив, али има токсично дејство. Хемијска формула натријум перхлората је НаЦлО 4 .
Геттинг
Описана супстанца се може добити и хемијски и електрохемијски. У првом случају, обично се користи уобичајена реакција размене између перхлорне киселине и хидроксида или натријум карбоната. Могуће је и термичко разлагање натријум хлората. На 400-600 ° Ц, формира перхлорат и натријум хлорид. Али овај метод је прилично опасан, јер постоји опасност од експлозије током реакције.
Теоретски, могуће је извршити хемијску оксидацију натријум хлората. Најефикасније средство за оксидацију у овом случају биће оксид олова (ИВ) у киселој средини. Обично се у реакциону смешу додаје перхлорна киселина.
Најчешће у индустрији се користи електрокемијска метода. Он даје чистији производ и генерално ефикаснији. Као сировина користи се исти натријум-хлорат, који након оксидације на платинској аноди производи перхлорат. Да би процес био економичнији, натријум хлорат се производи на јефтинијим графитним електродама. Постоји и обећавајући метод за производњу натријум перхлората у једној фази. Као анода се користи олово пероксид.
Елецтроцхемицал Мецханисмс
Механизам оксидације хлората у перхлорат још није у потпуности разјашњен, постоје само претпоставке о томе. Истраживања су у току.
Најразумнија је варијанта заснована на претпоставци електроновог удара на аноди клоратног јона (ЦлО 3 - ), због чега настаје ЦлО 3 радикал. Он, заузврат, ступа у интеракцију са водом да би формирао перхлорат.
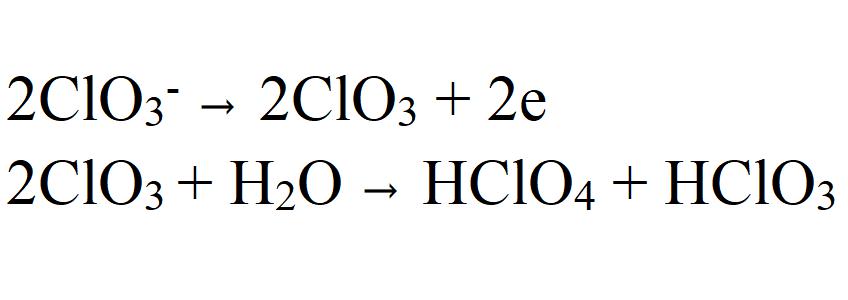
Ова претпоставка је изражена у низу угледних научних радова. То потврђују и резултати истраживања оксидације хлората у перхлоратима у воденим растворима обележеним тешким изотопима кисеоника 18 О. Нађено је да је 18 О прво укључен у хлорат и тек тада у току оксидативног процеса постаје део перхлоратног јона. Али мора се имати на уму да промена анодног материјала (на пример, од платине до графита) може такође да промени механизам реакције.
Друга варијанта процеса је оксидација клоратних јона са кисеоником, који се формира када се електрон ослободи од хидроксидног иона.
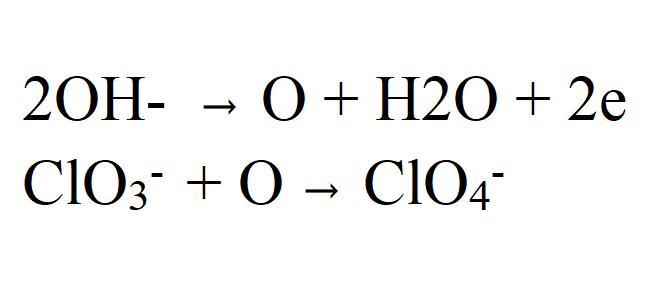
Према овој варијанти, брзина реакције директно зависи од концентрације хлората у електролиту, тј., Са смањењем његове концентрације, брзина треба да се повећа.
Постоји и опција која се заснива на истовременом ослобађању електрона од хлоратног јона и хидроксидног јона. Добијени радикали су високо активни и оксидују се кисеоником, који се ослобађа из ОХ - .
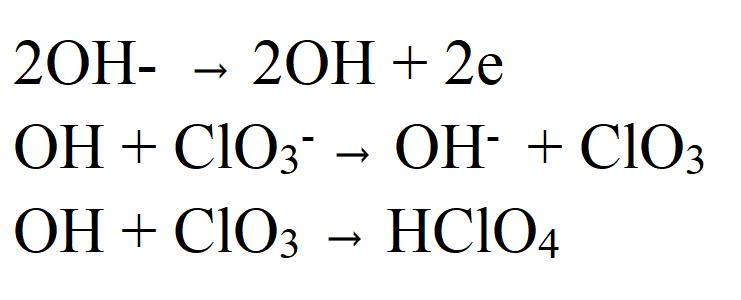
Пхисицал пропертиес
Натријум перхлорат је веома растворљив у води. Његова растворљивост је много јача од других перклората. Из тог разлога, у производњи перхлората, прво се производи натријум перхлорат, а затим, ако је потребно, преноси се на друге соли перхлорне киселине. Такође је добро растворљив у течном амонијаку, ацетону, водоник пероксиду, етанолу и етилен гликолу.

Као што је горе поменуто, то је хигроскопно, а када се хидролизује, натријум перхлорат формира кристалне хидрате (моно- и дихидрате). Такође може да формира солвате са другим једињењима. На температури од 482 ° Ц топи се са распадом на натријум хлорид и кисеоник. Када се користе адитиви натријум пероксида, манган (ИВ) оксида, кобалтовог оксида (ИИ, ИИИ), температура распадања се смањује на 150-200 ° Ц.
Хемијска својства
Натријумова сол перхлорне киселине је јако јако оксидационо средство, толико да оксидира многе органске супстанце у угљен диоксид и воду.
Перхлоратни јон се може детектовати реакцијом са амонијумовим солима. Приликом калцинације смеше, реакција се наставља:
3НаЦлО4 + 8НХ4НО3 → 3КЦл + 4Н2 + 8ХНО3 + 12Х2О.
Други метод детекције је реакција размене са калијумом. Калијум перхлорат је много мање растворљив у води, тако да ће се таложити.
НаЦлО 4 + КЦл → КЦлО 4 + НаЦл.
Са другим перхлоратима могу да формирају комплексна једињења: На2 [Ал (ЦлО 4 ) 5 ], На [Зн (ЦлО 4 ) 3 ], На [Цд 2 (ЦлО 4 ) 5 ].
Апплицатион
Због формирања кристалних хидрата, употреба натријум перхлората је изузетно тешка. Углавном се користи као хербицид, мада последњи пут мање. Готово сав натријум перхлорат се претвара у друге перхлорате (на пример, калијум или амонијум) или перхлорну киселину и користи се у синтези многих других једињења због својих јаких оксидационих особина. Такође се може користити у аналитичкој хемији за одређивање и таложење калијумових, рубидијумских и цезијумских катиона, како из водених тако и из алкохолних раствора.
Термичка разградња свих перхлората производи кисеоник. Због тога се сол може користити као извор кисеоника у ракетним моторима. Неки перклорати се могу користити у експлозивима. Калијум перхлорат се користи у медицини за лечење хипертиреозе. Ова болест је последица повећане функције штитне жлезде, а сваки перклорат има својство да смањи активност ове жлезде, која је неопходна да би се тело нормализовало.
Опасност
Сам натријум перхлорат није запаљив, али у интеракцији са неким другим супстанцама може изазвати пожар или експлозију. У пожару, може испуштати отровне гасове или паре (хлор или хлороксиде). Гашење се може обавити водом.
Натријум перхлорат на собној температури практично не испарава, али када се попрска, може ући у тело. Када се удише, кашља се јавља иритација слузокоже. У контакту са кожом појављује се црвенило. Као прву помоћ, препоруча се опрати мјеста с пуно воде и сапуна, као и да се ослободи контаминиране одјеће. При продуженом излагању телу, он улази у крвоток и доводи до стварања метхемоглобина.
Када су животињама (нарочито глодавцима) даване 0.1 г натријум перхлората, повећана је њихова рефлексна побудност, појавиле су се конвулзије и тетанус. После давања 0.22 г, пацови су умрли после 10 сати. Увођењем исте дозе голубова имали су само благе симптоме тровања, али након 18 сати умрли су. То сугерише да се примена натријум перхлората развија веома споро.