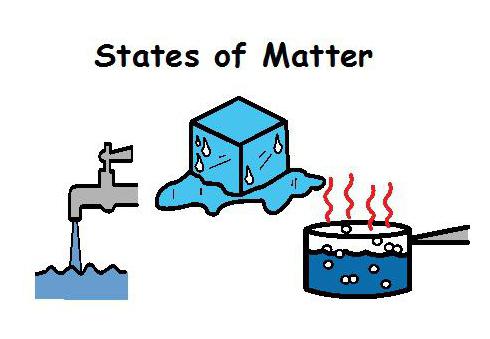
Агрегатно стање материје. Промена стања материје
Сва материја може постојати у једном од четири типа. Свака од њих је одређено агрегатно стање материје. У природи Земље, само је један представљен у три одједном. Ово је вода. Лако се види и испарава, топи се и очврсне. То јест, пара, вода и лед. Научници су научили да мењају агрегацију материје. Највећа потешкоћа за њих је само плазма. Ово стање захтева посебне услове.

Шта је то, од чега зависи и како се она карактерише?
Ако је тело прешло у друго стање агрегације супстанце, то не значи да се појавило нешто друго. Супстанца остаје иста. Ако течност има молекуле воде, оне ће бити исте са паром са ледом. Промениће се само њихова локација, брзина кретања и снаге међусобне интеракције.
Када се проучава тема „Агрегатне државе (8. разред)“, разматрају се само три од њих. Јесте течни гас анд солид. Њихове манифестације зависе од физичких услова околине. Карактеристике ових стања су приказане у табели.
| Назив стања агрегације | солид боди | течности | гас |
| Његова својства | задржава облик запремине | има сталну запремину, има облик посуде | нема константан волумен и облик |
| Распоред молекула | у тачкама решетке | ерратиц | хаотичан |
| Удаљеност између њих | упоредив са величином молекула | приближно једнака величини молекула | знатно веће од њихове величине |
| Како Молецулес Мове | лебдите око решетке | не померајте се са места равнотеже, већ понекад правите велике скокове | случајни са повременим сударима |
| Како су у интеракцији | јако привлачи | снажно привлаче једни друге | не привлаче, одбијајуће силе се јављају при удару |
Прво стање: чврсто
Његова суштинска разлика од других је у томе што молекуле имају строго дефинисано место. Када говоре о чврстом стању агрегације, често се односе на кристале. У њима је структура решетке симетрична и строго периодична. Дакле, увијек је сачувана, колико далеко тијело не би проширило. Осцилаторно кретање молекула супстанце није довољно да уништи ову решетку.
Али има и таквих аморфна тела. Недостаје им стриктна структура распореда атома. Могу бити било гдје. Али ово место је стабилно као у кристалном телу. Разлика између аморфних и кристалних супстанци је у томе што немају одређену тачку топљења (очвршћавање) и за њих је карактеристична течљивост. Живописни примери таквих супстанци: стакло и пластика.
Друго стање: течно
Ово агрегатно стање материје је укрштање између чврстог и гасовитог. Дакле, комбинује нека својства првог и другог. Дакле, удаљеност између честица и њихова интеракција је слична оној у кристалима. Али локација и кретање ближе гасу. Због тога течност не чува облик, већ се шири преко посуде у коју се улива.
Трећа држава: гас
За науку која се зове "физика", агрегатно стање у облику гаса није на последњем месту. На крају крајева, она проучава свет, а ваздух у њему је веома чест.
Посебности овог стања су да су силе интеракције између молекула практично одсутне. Ово објашњава њихово слободно кретање. Због тога гасовита супстанца испуњава целокупну количину која му се даје. И у овом стању можете пренијети све, само требате повећати температуру на жељену вриједност.
Четврто стање: плазма
Ово агрегатно стање материје је гас који је потпуно или делимично јонизован. То значи да је број негативно и позитивно наелектрисаних честица у њему скоро исти. Ова ситуација настаје када се гас загријава. Затим долази до наглог убрзања процеса термичке јонизације. Она лежи у чињеници да су молекули подељени на атоме. Потоњи се затим претварају у ионе.

У оквиру универзума, такво стање је веома уобичајено. Зато што садржи све звезде и окружење између њих. Унутар граница Земљине површине, јавља се изузетно ријетко. Осим за јоносферу и соларни ветар, плазма је могућа само током олује. У трептају муње стварају се такви услови у којима гасови атмосфере прелазе у четврто стање материје.
Али то не значи да се плазма не ствара у лабораторији. Прва ствар која је била у стању да репродукује је плинско пражњење. Сада плазма испуњава флуоресцентна светла и неонске рекламе.

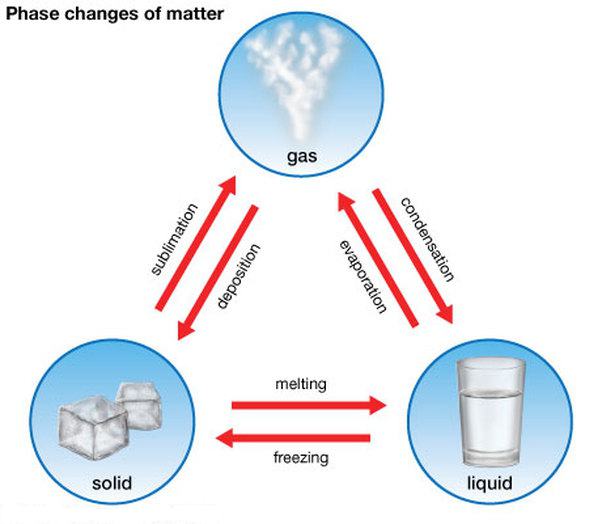
Како је транзиција између држава?
Да бисте то урадили, морате створити одређене услове: константан притисак и специфичну температуру. У овом случају, промена агрегатног стања супстанце је праћена ослобађањем или апсорпцијом енергије. Штавише, овај прелаз се не дешава брзином муње, али захтева одређену количину времена. Током овог времена услови морају бити непромењени. Транзиција се дешава са истовременим постојањем супстанце на два начина, који одржавају топлотну равнотежу.
Прве три стања материје могу ићи једна у другу. Постоје директни и обрнути процеси. Они имају следећа имена:
- топљење (од чврстог до течног) и кристализација , као што је топљење леда и очвршћавање воде;
- испаравање (од текућег до плиновитог) и кондензације , примјер је испаравање воде и њена производња из паре;
- сублимација (од чврстог до гасовитог) и десублимација , на пример, испаравање суве ароме за прву и мраз на стаклу до другог.
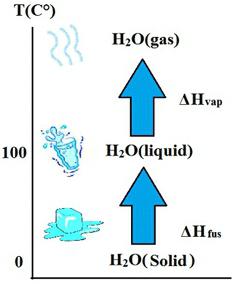
Физика топљења и кристализације
Ако се чврста материја загрева, онда на одређеној температури, која се назива тачка топљења одређене супстанце, започиње промена агрегатног стања, звана топљење. Овај процес долази са апсорпцијом енергије, која се назива количина топлоте и означена је словом К. Да бисте је израчунали, морате знати специфичну топлину фузије , која је означена са λ . И формула узима следећи израз:
К = λ * м , где је м маса супстанце која је укључена у топљење.
Ако се деси обрнути процес, тј. Кристализација течности, услови се понављају. Једина разлика је у томе што се енергија ослобађа, а у формули се појављује знак минус.
Физика испаравања и кондензације
Са наставком загревања супстанце постепено ће се приближавати температури на којој ће почети њено интензивно испаравање. Овај процес се назива испаравање. Опет се карактерише апсорпцијом енергије. Само за израчунавање је потребно знати специфичну топлоту испаравања р . И формула ће бити:
К = р * м .
Реверзни процес или кондензација се дешава са ослобађањем истог количине топлине. Дакле, у формули се поново појављује минус.