Врсте хемијских реакција. Класификација хемијске реакције
Појам о томе које су врсте хемијских реакција нераскидиво је повезан са основним знањем о предмету, који се обавезно предаје у школи. За разлику од физичке метаморфозе, у хемији постоји трансформација супстанце из једне или више у другу или неколико других. На томе се заснивају готово све врсте хемијских реакција.
Фактори хемијске реакције
До данас је идентификовано довољно велики број реакција које на овај или онај начин припадају области хемије и физике. Међутим, класификација хемијских реакција је таква да их се може проценити по неким основним карактеристикама. Најчешће су то знакови визуелне природе.

На пример, најлакши начин да се утврди да ли је дошло до хемијске реакције или не, јесте промена боје супстанце или раствора, таложења, еволуције гаса итд. Све то није тешко приметити, како кажу, чак и око. У неким случајевима, овај метод не ради. Нарочито, ово се односи на течне реагенсе као што су киселине и базе када се растворе у води. Иако је овај процес искључиво везан за физичке процесе, ипак се хидратација или хидролиза разматра управо са становишта науке као што је хемија. Хемијске реакције одређује се додатним средствима. На примјер, ако одредите пХ отопине, овдје нећете видјети ништа визуално. Решења се користе да означе лакмус папир која је обојена у одређеној боји у зависности од киселости подлоге.

Међутим, дефиниција није ограничена само на визуелне ефекте. Ово се може потврдити и другим не мање приметним факторима који се појављују током курса или краја процеса. А има их доста.
Једнако занимљива особина је повећање температуре или пожар у споју. Довољно је подсјетити се на школска искуства када се комад калијума баци у воду, након чега се ослобађа водик. Ако узмете довољно велики комад овог метала и праву количину воде, можете чак постићи чињеницу да ће се догодити експлозија невероватне силе. Имајте на уму да такви случајеви у историји, нажалост, нису јединствени.

Главни типови хемијских реакција
Што се тиче врсте хемијских реакција које се могу разликовати на садашњем ступњу развоја хемије, овдје се на почетку може напоменути да се процеси могу иницијално и увјетно подијелити на хомогене и хетерогене. Хомогени процеси се одвијају у истој фази (рецимо, у течној), а хетерогене реакције користе неколико стања супстанце (течности, чврсте материје, гаса, итд.) Као главне реактанте.
Али таква подела на типове хемијских процеса далеко је од јединственог, јер је овде неопходно узети у обзир управо конверзију супстанци које учествују у реакцији из једне у другу.
Исти алкемичари покушали су једном да добију злато из олова. У ствари, овај процес се може приписати хемији прилично индиректно.

У ствари, трансформација једног елемента у други припада, прије, пољу нуклеарне физике. Данас је могуће произвести такав процес, међутим, злато добијено на тај начин постаје врло високо радиоактивно, невјеројатно скупо и једноставно није погодно за употребу.
Међутим, у основном разумевању поделе на класе хемијских реакција треба разликовати најчешће типове. У основи су узети четири главне класе: реакција једињења, разградња, супституција и јонска размена. Постоји и пети тип, који се у својој суштини не уклапа ни у једну од горе наведених класа. То су редокс реакције, у којима се, по правилу, калијум перманганат (КМнО 4 ) понаша као главни реагенс, који се, заједно са киселинама, сматра једним од најмоћнијих оксидационих средстава познатих човечанству.

Реакције једињења
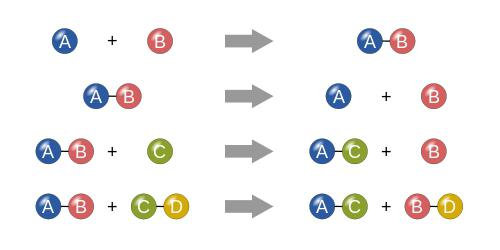
Ако говоримо о условима хемијских реакција овог типа, условно, сам процес се може представити као нека врста математичког израза. Претпоставимо да имамо две супстанце. Уобичајено, означавамо их као “А” и “Б”. У овом случају, реакција ће имати облик сљедеће формуле:
А + Б = АБ
Као што је већ јасно, једноставно постоји фузија две компоненте (било да се ради о једноставним или сложеним супстанцама, које су једињења).
Најједноставнији примјер је стварање оксида. На пример:
С + О2 = СО2
Реакције разлагања
У ствари, класификација хемијских реакција је немогућа без разумевања процеса разлагања. На основу горе наведеног примера, сам процес се може представити као формула:
Кс = АБ - А - Б ,
где је АБ почетна супстанца, а А и Б су састојци у којима ће се разградити. Сходно томе, Кс је резултат, који представља две компоненте А и Б, које на крају реакције не реагују једна са другом.
Реакције замене
Услови хемијских реакција са супституцијом такође имају своје карактеристике. На основу једноставне математике, овај тип процеса се може описати следећим примером:
Претпоставимо да имамо неко једињење у облику две компоненте “АБ” и одређену супстанцу “Ц”. У том погледу, реакција супституције ће бити:
АБ + Ц = АЦ + Б или АБ + Ц = БЦ + А.
Другим речима, јавља се уобичајена замена једне или више компоненти за другу.
Реакције јонске измене
Брзину хемијске реакције најбоље илуструје примјер реакција ионске измјене, када се реактанти измјењују с ионима (набијеним честицама). У овом случају, може бити максимално, јер се конверзија једне супстанце у другу одвија на молекуларном нивоу. У математичком изразу, ова формула има облик:
АБ + ЦД = АД + ЦБ (или у другим варијацијама).
У суштини, реакције ионске измене су донекле сличне реакцијама супституције, иако припадају посебној класи.
Редокс реакције
Што се тиче реакција овог типа, оне су међу свим познатим најсложенијим (да не спомињемо реакције синтезе). Чињеница је да чак и прављење уобичајене хемијске једначине која укључује калијум перманганат без посебног знања једноставно неће функционисати. Овдје је потребно узети у обзир не само валенцију сваке почетне компоненте, већ и валенцију коју компоненте стичу након завршетка процеса. У већини случајева, валенца може да варира у прилично широким границама, а резултат реакције две почетне компоненте може бити формирање три или четири једињења.
Фактори који утичу на брзину хемијских реакција
Сам степен хемијске реакције зависи од способности реактаната да уђу у процес, као и од неких додатних услова, као што је температура. Најједноставнији пример је употреба катализатора - супстанце која може убрзати хемијску реакцију. На пример, да би се то успорило у неким случајевима, могу се користити супстанце као што су инхибитори, адсорбенти, апсорбенти итд. Свака таква супстанца може имати значајан утицај на читав хемијски процес и брзину протока.
Међу супстанцама овог типа, обичан човек је упознат са активним угљем, који је способан да апсорбује киселине или базе, у зависности од средине у којој се налази.

Закључак
Као што можете видети, врсте хемијских реакција које обичан човек може да схвати су прилично једноставне. Најважнија ствар у овом питању је јасно разјаснити шта је процес. Обратите пажњу, у овом случају, разматрали смо хемијске процесе засноване на једноставној математици, без улажења у детаље хемије. Чини се да ће овај приступ помоћи да се објасни суштина главних хемијских процеса, да тако кажемо, “на прстима”. Штавише, са становишта математике ће свако моћи да разуме шта је то неки конкретан процес.
У овом случају, не разматрају се хемијске реакције и системи у којима више од два реактанта интерагују. Да бисте их разумели, морате имати одређено знање. Само са њима ће бити могуће направити исту једнаџбу која описује овај процес, да не спомињемо органску хемију, гдје ће се, да би се разумјело шта је супстанца, чак и морати примијенити структурне формуле, на примјер, на основи бензенског прстена или везаних радикала.
У овом случају, морате се одвојити од уобичајених основа неорганска хемија који описује већину процеса најједноставније и концизније. То је истина, јер у зору развоја саме органске науке, нико није имао појма, међутим, резултати открића и многа истраживања једноставно задивљују.