Шта је геометријски изомер?
Геометријски изомери су цис-транс изомерија или ЕЗ изомерија. Њихова дејства се заснивају на ограниченој ротацији двоструких или појединачних веза угљеника у цикличним једињењима.У цикличној вези, ротација између једноструке везе угљеника је ограничена и две различите групе су везане на сваки угљенични изомеризам на сличан начин. Такви геометријски изомери често се разликују по својим физичким својствима. То је због облика изомера и укупног диполног момента. Ако два атома са највишим приоритетом остану на истој страни изомера, они се означавају као З, а ако се налазе на супротној страни, Е.
Кратка историја изомеризма
Концепт уставног изомеризма је значајан корак напред у историји модерне хемије, а посебно у развоју органске хемије. До краја 1700-тих, неколико чистих супстанци је изоловано проучавањем "животињске" и "биљне" хемије. Многе су примили Карл Вилхелм Шеле (1742-1786). Због велике разноликости органских једињења, свака нова супстанца представљала је различит елементни састав, што је одговарало генерализованом посматрању "минералне" хемије. Број изолованих органских једињења повећао се почетком 1800-их, кроз идентификацију различитих супстанци.
У својој историјској књизи хемије, Тхомас Тхомсон је написао 1830. да:
Берзелиус је применио теорију атома и на биљно царство, након што је анализирао неколико биљних киселина и показао своју атомску конституцију, али ту се јавља потешкоћа, коју не можемо савладати у садашњем стању нашег знања. Постоје две киселине које се састоје од истих атома. Како да објаснимо ову упечатљиву разлику у имовини? Несумњиво, на различите начине у којима се атоми налазе у свакој од њих.
Тхомсон је затим користио различите схеме атомских симбола које су се тада користиле да би објаснио зашто две киселине са истим елементарним саставом, које се односе на геометријске изомере, имају различите физичке и хемијске особине.
Све до почетка КСИКС века веровало се да ове хемикалије које се налазе у живим организмима имају посебну животну силу повезану са живим бићима, и да су потребне у живим системима за репродукцију. Године 1828. Вохлер је синтетисао узорак урее, (НХ2) 2ЦО (такође ЦХ4Н2О), који се није могао разликовати од уреје изоловане из биолошког урина.
Он је припремио ову "животињску" супстанцу из јасно неорганског (минералошког) полазног материјала амонијум цијаната, (НХ4) НЦО (такође ЦХ4Н2О), што је резултат комбиновања амонијум хлорида и сребро цијаната. Тако је баријера између "живог" и "неживог" изомеризма пропала.
Означавање изомера
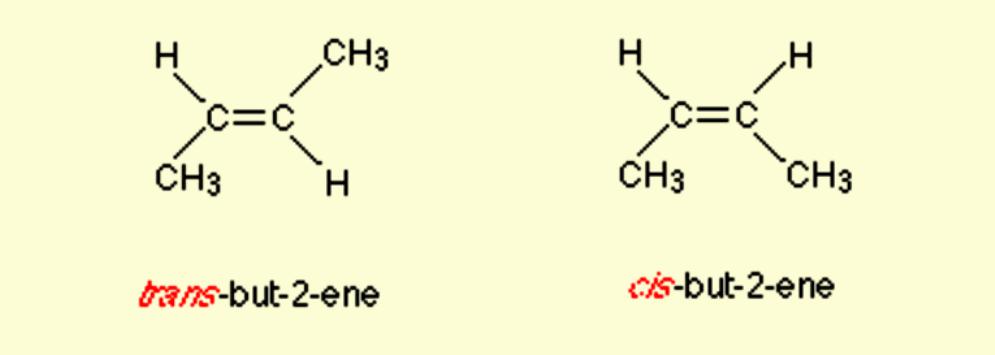
У цис-изомеру две такве групе остају на истој страни двоструке везе, док у транс-изомеру остају у супротном смеру. На пример, 2-бутен има два цис и транс изомера.
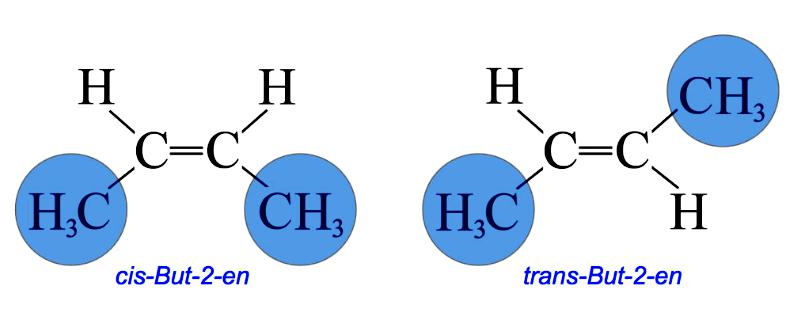
У цис-изомеру, две метилне групе и две групе водоника остају у истој страни двоструке везе, док у транс-изомеру остају у супротном смеру.
Када једна или више група повезаних на двоструку везу нису исте, изомери се зову Е или З. Да би се обавестио овај тип, корисник ће морати да одреди формуле угљоводоника који имају геометријске изомере и одреде атом са највишим приоритетом (највећи атомски број) везан за сваку двоструку везу Ц. Ако два атома са највишим приоритетом остану на истој страни изомера, који је означен као З, и, ако се налазе на супротној страни, означени су као Е.

На пример, 1-бромо-1-флуоропропан има два изомера. У З-1-бром-1-флуоропропану, може се видети да бром има већи приоритет или већи атомски број (35) од флуора (9), који су везани за Ц-1. Угљеник има већи атомски број (6) од водоника (1), који је везан за Ц-2 овог једињења. Пошто су атоми угљеника са највећим приоритетом (из групе -ЦХ3) и брома везани за ова два атома угљеника на истој страни, ово једињење је дефинисано као З. С друге стране, у Е-1 - бром - 1 - флуоропропану са највећим бројем Приоритет Ц и бром су у супротном смеру, тако да се назива Е-изомер.
Карбон-угљеник двострука веза
Изомери су два молекула који имају исти атомски састав, али нису идентични. Атоми у два изомера могу бити повезани у различитим редовима (структурна изомерија), или могу бити повезани на исти начин, али имају различиту оријентацију - просторни стереоизомеризам.
Структурни и геометријски изомер у посебним случајевима, стереоизомер, мора да испуњава два захтева:
- Постоји ограничена ротација у молекулу.
- Оба атома укључена у рестриктивну везу имају за њих две различите функционалне групе.
Уобичајени пример ограничене ротације је двострука веза угљеник-угљеник. Ове везе укључују везу пи, у већини услова није исплативо разбијати их.
Геометријски изомери имају структуру која утиче на физичке особине једињења.
Цис / Транс систем
Именовање Цис / Транс је најлакши систем за повезивање. Прво, идентификован је најдужи ланац угљеника у молекулу, а затим су идентификоване функционалне групе од интереса. У цис изомеру, две групе о којима је реч су на истој страни двоструке везе (цис значи "на истој страни" на латинском). У транс-изомеру, две групе које се разматрају су на супротним странама двоструке везе (транс значи преко латинског језика). На пример, два различита геометријска изомера бутена-2.
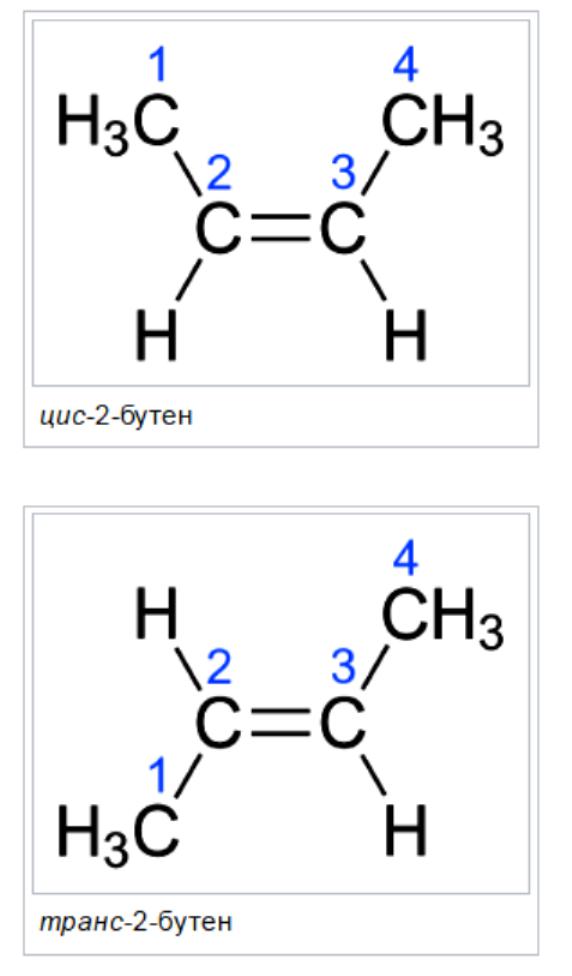
Оба атома са двоструком везом имају исте две групе као ове две групе, али се разликују једна од друге на једном од двоструких угљеника. Задатак је компликован како бочни ланци и функционалне групе постају сложеније.
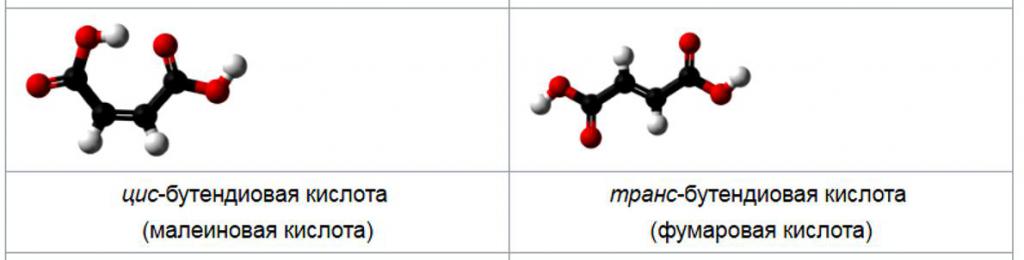
Званична ИУПАЦ-ова конвенција о именовању је Е / З. Не постоји специфичан однос између цис / транс и Е / З, а ова два система нису заменљива. Ознака Е / З користи Цахн-Инголд-Прелог правила приоритета и сматра се поузданијим. Назив ИУПАЦ за фумарну киселину је транс-изомер са формулом ХО2ЦЦХ = ЦХЦО2Х, а малеинска киселина је цис-бутандична киселина.
ИУПАЦ је Међународна унија чисте и примењене хемије, која поставља међународна правила и стандарде за означавање хемикалија на свим језицима.
Циклична једињења
У цикличној вези, ротација између угљеничне једноструке везе је ограничена. Према томе, изомерија је такође могућа за овај тип једињења ако су две различите групе везане за сваки угљеник. Постоје два изомера 1,2-диметилциклопропана.
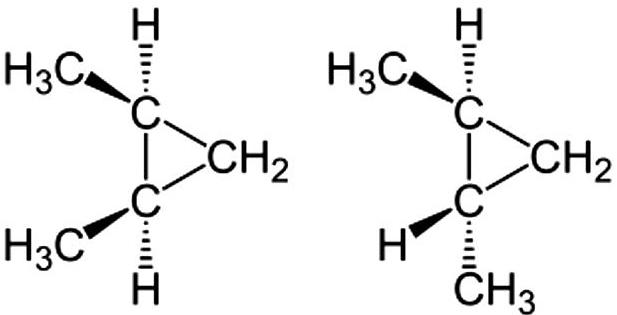
Један од њих је цис изомер, где су две метилне групе на једној страни, а друга је транс изомер, где су две метилне групе на другој страни.
Геометријски изомери се разликују по својим физичким својствима. То је због облика изомера и укупног диполног момента. На пример, они се разликују по тачки кључања. Тачка кључања цис- и транс-изомера 1,2-дихлороетилена је 60,3 ° Ц и 47,5 ° Ц, респективно.
У цис-изомеру, присуство две диполне везе (Ц-Цл) даје укупни молекулски дипол. То доводи до интермолекуларних дипол-диполних сила. За ову силу, цис-изомер има вишу тачку кључања од транс-изомера, где су две диполне везе (Ц-Цл) отказане због њиховог положаја у супротном смеру.
Разлог зашто није могуће ротирати двоструку везу угљик-угљик је да постоје двије везе које заједно спајају атоме угљика и морате прекинути пи везу. Пи везе се формирају током латералног преклапања п-орбитала. Ако покуша да претвори двоструку везу угљеник-угљеник, п-орбитале више неће поравнати, и зато ће се везати пи. Енергија се троши на ово, а то се дешава само ако је комплекс веома врућ.
Конструкција структурних формула
Веома је лако изоставити важне елементе геометријских изомера током конструкције структурних формула током контракције. На пример, веома је примамљиво да нацртате бут-2-ен.Ако корисник ово пише погрешно, онда спој више неће бити изомер. Ако постоји чак и најмањи наговештај да се може користити изомер, увек је потребно користити једињења која садрже двоструке везе угљеник-угљеник показујући исправне углове (120 °) око атома угљеника на крајевима везе. Другим речима, морате користити формат приказан на слици.
Једињења која садрже двоструку везу угљеник-угљеник имају ограничену ротацију. За добијање изомера морају бити испуњени следећи услови:
- ограничена ротација, обично укључује двоструку везу угљеник-угљеник;
- две различите групе на левом крају везе и две различите групе на десном крају.
Није битно да ли се леве групе поклапају са десним или не.
Алкенес: Молекуларне и структурне формуле
Геометријски изомери алкена укључују низ једињења која се састоје од Ц и Х атома у угљеничном ланцу. Ова група укључује хомологне серије са формулом ЦнХ2н. Најједноставнији алкен је етен, има два Ц-атома и формулу Ц2Х4.
Структурна формула за етен је приказана на слици горе. У дужим ланцима алкена, додатни атоми угљеника су везани један за други користећи неке ковалентне везе. Сваки атом угљеника је такође везан за довољно атома водоника да произведе укупно четири једноструке ковалентне везе.
У ланцима са четири или више Ц-атома, двострука веза може бити лоцирана у различитим положајима, што доводи до формирања структурних изомера. Поред структурних изомера, алкени такође формирају стереоизомере. Пошто је ротација око вишеструке везе ограничена, групе везане за атоме са двоструком везом увек остају у истим релативним положајима.
Ове "блокиране" позиције омогућавају хемичарима да идентификују различите изомере из супституената како би утврдили која супстанца има геометријске изомере. На пример, један структурни изомер Ц5Х10 има следеће стереоизомере.
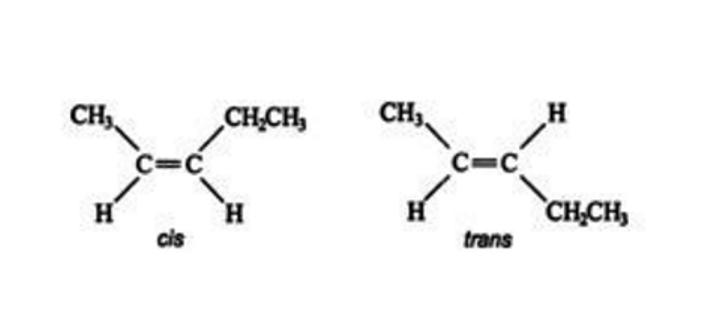
Изомер на левој страни, у коме су два супституента (метил и етил групе) на истој страни двоструке везе, назива се цис изомер, док је изомер на десној страни са два супституента који нису водоник на супротним странама је транс изомер.
На пример, хлор има предност јер је тежи. Са десне стране, бром је супериорнији од угљеника. Треће, одређени су положаји два атома вишег ранга. Ако су два атома у цис положају, локација је З (од немачких зусаммен, што значи "заједно"). Ако су атоми или групе у транс-позицији, локација је Е (од њемачког ентгегена, што значи "супротно").
Једињења тврде двоструке везе
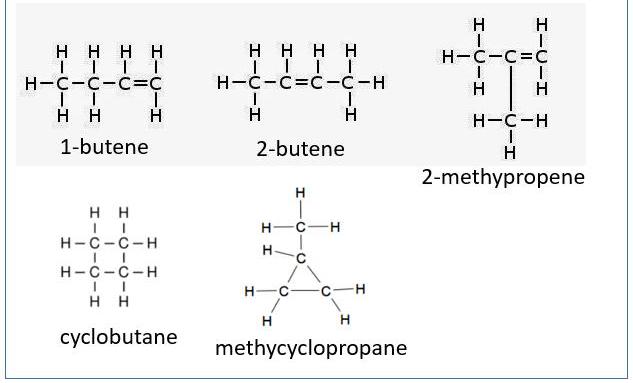
Геометријски изомери бутен је алкен са чврстом двоструком везом. То значи да постоје заправо четири изомера, а не три, у позицији двоструке везе. Постоје пети и шести угљоводоници истог састава, али они нису алкени, упркос истој формули.
Формирање прстена циклобутана или метилциклопропана заузима простор од два атома водоника као двоструку везу, што доводи до чињенице да имају формуле идентичне различитим бутенима.
Примери геометријских изомера:
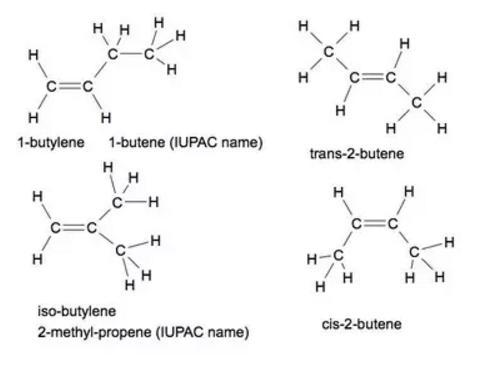
- 1-бутилен (1-бутен);
- изо-бутилен (2-метил-пропен);
- цис-2-бутилен (цис-2-бутен);
- транс-2-бутилен (транс-2-бутен).
И бонуси: циклобутан и метилциклопропан, оба имају исту емпиријску формулу као изомере бутена, али нису алкени. Прво име је "заједничко" или "тривијално" име, а име у заградама је име ИУПАЦ.
Бутене изомери
Бутен има много користи, од горива у аутомобилу до врећица за намирнице које стотине милиона људи широм свијета носе сваки дан. Хемијска формула за бутен: Ц4Х8, што значи да се састоји од четири Ц атома и осам Х атома, једињење се односи на алкен.
Постоји неколико различитих изомера или молекуларних структура које могу да формирају ово једињење (ИУПАЦ имена су приказана у заградама):
- алфа-бутилен (бут-1-ен);
- цис-бета-бутилен - ((2З) -бут-2-ен);
- транс-бета-бутилен - ((2Е) -бут-2-ен);
- изобутилен (2-метилпроп-1-ен).
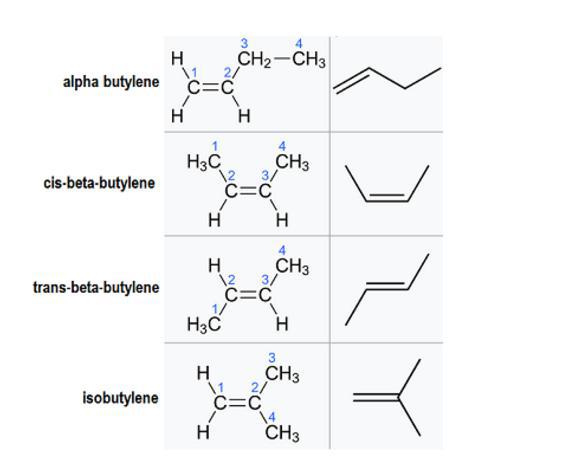
Иако сви имају исту формулу, њихове структуре су различите. Односи између сваког од ових геометријских изомера су у основи уставни, што значи да имају исту молекулску формулу, али различите везе. Изузетак је цис-бета-бутилен и транс-бета-бутилен.
Многи људи знају да су транс масти штетне за људе, а незасићене масти су добре за њих. Једина разлика између ове две масти је у томе што једна има транс везу, а друга има цис везу, међутим, ова мала диференцијација може значајно утицати на функцију молекула.
Код цис-бета-бутилена и транс-бета-бутилена, атоми су у истом поретку, али су поларитети различити. Цис изомер је поларни, са обе ЦХ3 групе на истој страни. То га чини заиста компликованим и комплексним, транс-изомер је неполаран, волуметријске групе ЦХ3 се измјењују, што даје више простора у молекулу. Овај однос се назива цис-транс-изомеризам. Цис изомери су поларни, док транс изомери нису.
Упркос чињеници да се сваки од ових изомера бутена састоји од истих материјала, сваки од њих има различите физичке особине. На пример, тачка кључања:
- Цис-бета-бутилен: 3,7 ° Ц.
- Транс Бета Бутилен: 0.8 ° Ц.
- Изобутилен: -6.9 ° Ц.
- Алфа бутилен: -6,3 ° Ц.
Материјал за производњу пластике
Бутени су алкени са четири атома угљеника, Ц4Х8. Постоји неколико различитих структурних или конфигурационих изомера бутена, укључујући геометријске и оптичке изомере. Сва четири бутена имају слична физичка својства, безбојни гасови, тешки у води, лако растворљиви у етру и алканима. Разлике у физичким својствима објашњавају се структуром молекула. На пример, цис-Бут-2-ен има вишу тачку кључања од транс-Бут-2-ен, јер је јачи дипол.
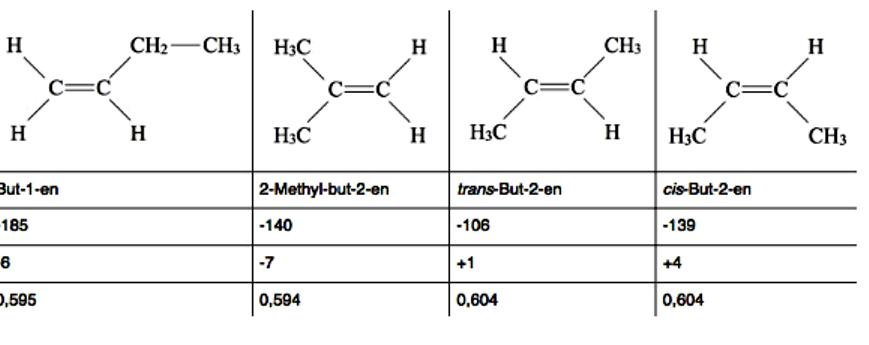
Две алкил групе цис-изомера раде са својим + И ефектом у једном смеру и тиме се повећавају, док две алкил групе транс-изомера делују у супротним правцима и, према томе, међусобно слабе. Формуле за угљоводонике са геометријским изомерима су назначене ИУПАЦ стандардима. Бут-1-ен има тако ниску тачку топљења, јер је ЦЦ једна веза између другог и трећег атома угљеника, слободна ротација и етилна група могу ротирати око осе ротације у свим правцима.
То отежава класификацију молекула у чврсту кристалну структуру. Преостала три бутена са двоструком везом између 2. и 3. Ц-атома су веома крута и могу се лако класификовати у кристалну структуру. Дакле, имају релативно високе тачке топљења. Ови аргументи нису увек валидни, јер пример показује 2-метил-бут-2-ен (или изобутен). Две метилне групе са својим + И ефектима делују у истом смеру као цис-Бут-2-ен, и заправо треба да се побољшају. Међутим, изобутен има веома ниску тачку кључања од само -7 ° Ц.
Бут-1-ен и Бут-2-ен се користе за добијање бутадиена и бутан-2-ола. Поред тога, алкени се користе као агенси за алкилацију. Према томе, важно гориво 2,2,4-триметил-пентан, познатији као изооктан, добија се из изобутена и изобутана. Коначно, бутени су полазни материјали за производњу неких пластика, јер се лако полимеризују. Позната пластика на бази Бут-1-ен, је полибутен-1, из које су направљене цеви.
Пентан, н-пентан, изопентан
Пентан или н-пентан је један од засићених алканских угљоводоника. Готово без мириса, н-пентан је течан под околним условима и изомер је 3 изомера херакетита. Разгранати течни изоалкани Ц5 - Ц16 све више се користе као гориво (Отто, Диесел). Поред тога, ови алкани су присутни у грејним уљима и мазивим уљима. Они обезбеђују потпуно сагоревање. Пре него што сазнате карактеристике ових једињења, морате навести формуле угљоводоника са геометријским изомерима:
- Физичко стање - флуид.
- Боја - безбојна.
- Мирис - готово не.
- Лако запаљиво.
- Паре могу створити експлозивне смјесе када су изложене зраку.
- Растворљивост у води је веома ниска (практично нерастворљива).
- Веома нестабилна веза.
Име | Н-пентан |
Цхемицал сигн | Ц5Х12 |
Моларна маса | 72.1488 кг / кмол |
Тачка паљења | 224 К |
Игните | 533 бар |
Тачка кључања - 1.013 бар | 309.2 К |
Критична температура | 469.8 К |
Критични притисак | 33.6 бар |
Топлота испаравања при тачки кључања | 357,46 кЈ / кг (25,79 кЈ / мол) |
Нип | 1,4% по запремини (41 г / м3) |
Гоо | 7,8% по запремини (235 г / м3) |
Експлозија | 9.5 бар |
Најважнији извори пентана су нафтна уља, која се значајно разликују по саставу у зависности од њиховог порекла. Одвајање се врши фракционом дестилацијом. Овде се добијају следеће фракције:
- Парафинско уље (врелиште> 320 ° Ц).
- Уље (тачка кључања 180 до 250 ° Ц).
- Грејање / дизел гориво (тачка кључања 250 до 320 ° Ц).
- Сирови бензин (точка кључања до око 180 ° Ц).
- У нафти постоје разгранати угљоводоници (алкани) од Ц5 до Ц10.
- Сагоревање пентана са кисеоником (стехиометријски).
- Крајњи производи су угљен диоксид и вода. Формуле геометријских изомера: Ц5Х12 + 8О2 ЦО 5ЦО2 + 6Х2О.
Име | Цхарацтерс | Калорична вредност ХУ [МЈ / кг] | Калорична вредност ХУ [кВх / кг] |
Метан | ЦХ4 | 50,013 | 13.89 |
Етхане | Ц2Х6 | 47.486 | 13,19 |
Пропан | Ц3Х8 | 46.354 | 12.88 |
Н-бутан | Ц4Х10 | 45.715 | 12.70 |
Н-пентан | Ц5Х12 | 45.0 | 12.50 |
Н-хексан | Ц6Х14 | 44.64 | 12.40 |
Н-хептан | Ц7Х16 | 44.64 | 12.40 |
Н-октан | Ц8Х18 | 44.64 | 12.40 |
Н-нонан | Ц 9 Х 20 | 44.64 | 12.40 |
Деан | Ц10Х22 | 44.64 | 12.40 |
Геометријски изомер пентен-2 је универзални растварач. Користи се за пењење фенолне смоле и полистирена. Такође је потребна као референтна супстанца у гасној хроматографији и као потисни гас у цилиндрима за распршивање.