Цхемистри. Оксиди: њихова класификација и својства
Међу различитим класама неорганских супстанци, издваја се комплекс бинарних једињења која се састоје од три групе. То су кисели, базични и амфотерни оксиди. Њихова класификација и својства зависе од атома од којих је хемијски елемент комбинован са кисеоником. У нашем чланку ћемо се упознати са типичним хемијским реакцијама карактеристичним за оксиде, као и открити генетску везу између њих и других класа неорганских једињења: базе, киселине и соли.
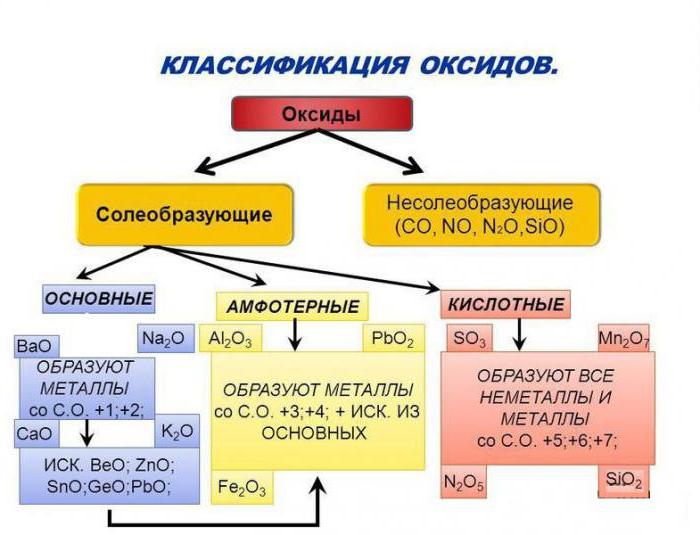
Карактеристике основних оксида
Размотрите једињења која садрже атоме типичних метала. На пример: ЦуО, ФеО, МгО садрже електричне неутралне честице бакра, гвожђа и магнезијума, што значи да су то основни оксиди. Њихова класификација и својства зависе од природе металног елемента. Ако састав супстанце садржи атоме алкалних или земноалкалних метала, онда су његови молекули у стању да ступају у интеракцију са водом.
Производ реакције, са ослобађањем великих количина топлоте, биће алкалија, на пример каустична сода или калцијум хидроксид. Неки оксиди, као што су бакар оксид или гвожђе, не реагује директно са водом, стога се њихове базе добијају индиректно: од одговарајућих соли, које интерагују са алкалијама. Главна ствар је њихова имовина - да реагује са киселинама, формирајући со и воду.
Који оксиди се називају киселим?
Класификација и својства киселина, база, оксида, соли одређују се прије свега њиховом способношћу међусобног дјеловања. Штавише, из супстанци из једне класе могуће је добити једињења друге групе. На тај начин, киселине се формирају у киселим оксидима у њиховим реакцијама са водом. Продукт хидратације сумпорног анхидрида, на пример, је сулфатна киселина, а пролаз угљен диоксида ЦО 2 кроз воду, добија се раствор слаб карбонска киселина. Према томе, кисели оксиди, њихова класификација и својства зависе од природе интеракције са водом и формирањем киселине. Такође додајемо да су у молекулу бинарних једињења атоми неметалних елемената везани за атоме кисеоника. Њихова најважнија имовина ће бити способност реаговања са алкалијама, производи ће бити сол и вода.

Зашто алуминијум реагује са киселинама и алкалијама?
Као што сте приметили, основни оксиди реагују са киселинама, кисели оксиди реагују са алкалијама. Једињења као што су Ал203 или ЗнО су амфотерни оксиди. Њихова класификација и својства се заснивају на способности ових супстанци да истовремено реагују са киселинама и активним базама. У интеракцији са алуминијум оксидом, на пример са сулфатном киселином, добија се његов сулфат. А у реакцији истог једињења са раствором натријум хидроксида формира се со - натријум-металуминат.
Као што можете видети, амфотерни елементи могу да формирају оксиде, који задржавају способност да реагују са алкалијама и киселинама. Долазе са формирањем соли. Узимајући у обзир оксиде, њихову класификацију и својства, немогуће је не рећи за другу групу ових бинарних једињења. Ако супстанца, као што је ЦО - угљен моноксид, или НО - азотни оксид, не може да реагује ни са киселинама ни са алкалијама, онда једињење није у стању да формира соли. Такви оксиди се називају индиферентни или индиферентни. Као што се сећамо, оксиди су бинарна једињења, која нужно укључују кисеоник.

Добијање оксида
Настављамо са разматрањем класификације, својстава, добијања оксида. Постоје три начина на који се једињења минирају у лабораторији. Најчешћа међу њима је оксидација једноставних супстанци. Изгарање комплексних једињења, као што је природни гас или нафта, је још један начин за производњу гасовитог угљеника и водикових оксида. Трећем методу додељујемо термичку разградњу одређених соли карбонске и азотне киселине, као и загревање нерастворних база, као што су бакар или хидроксид гвожђа. Ово формира металне оксиде и воду.
Интеракција оксида између њих
Проучавајући оксиде, њихову класификацију и хемијска својства, прелазимо на реакције између супстанци киселих и базичних група. Као резултат, они формирају једињења која припадају класи соли. На пример, ако се угљен-диоксид пропушта кроз раствор калцијум-оксида (вапнена вода), постаје замућен због формирања нерастворљивих честица калцијум-карбоната ЦаЦО3. У индустрији, широко се користе реакције интеракције неколико супстанци: оксиди натријума, калцијума и силиција. Загревајући своју мешавину заједно са техничком содом, узмите чашу.
Водиков оксид - вода има посебне карактеристике, о чему ћемо даље говорити. Х 2 О је најчешћа и неопходна материја на Земљи. Способност њених молекула да формирају водикове везе дају главна својства воде као универзални растварач са специфичним својствима: високи топлотни капацитет и топлотна проводљивост. Врло су важни за метаболичке процесе у живим организмима.
Вода, као оксид, реагује са различитим киселим и базним оксидима. У првом случају добијају се киселине, у другом - алкалије. Специфична реакција водиковог оксида је да се изврше реакције хидролитичке разградње (хидролизе). Они су веома чести међу њима органска материја порекла. То је хидролиза протеина, угљених хидрата и масти, која се одвија у гастроинтестиналном тракту, дељењу целулозе микроорганизмима - сапротрофима, итд.
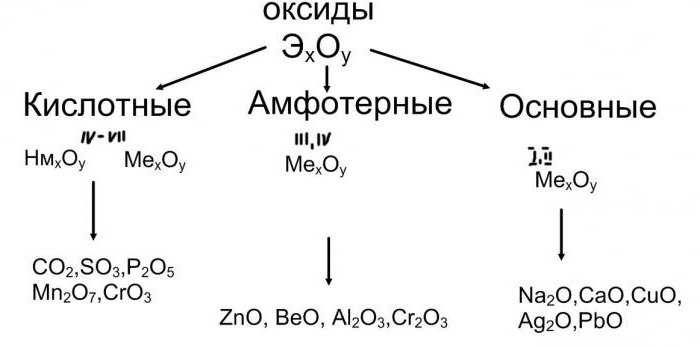
Оксиди, базе, соли: класификација, својства
Између главних класа неорганске супстанце постоји генетска веза која доказује могућност њихове међусобне трансформације. Дакле, од основног оксида активног метала, можете добити базу, а из ње - со. Пример таквог ланца трансформација је следећа шема: натријум оксид - натријум хидроксид - натријум карбонат. Кисели оксиди служе као почетна једињења у реакцијама са водом. Производ који се добија у овом случају је киселина. На пример: угљен диоксид - карбонатна киселина - натријум карбонат.
Реакција киселине са хидроксидима, која се назива неутрализација, доводи до појаве соли. У оба случаја, коначна карика у генетском ланцу биће једињење ове класе, повезујући заједно трансформације неметалних и металних хемијских елемената. Дакле, постоји обрнути механизам: од соли до база, киселина или једноставне супстанце.

У овом чланку смо проучавали класификацију и хемијска својства главних класа неорганских супстанци.