Хромов оксид: формула, карактеристике и хемијска својства
Међу разноврсним хемијским елементима и њиховим једињењима тешко је изабрати најкориснију супстанцу за човечанство. Сваки је јединствен по својим својствима и могућностима примене. Технички напредак знатно олакшава истраживачки процес, али и поставља нове задатке за њега. Хемијски елементи, откривени прије неколико стотина година и проучени у свим његовим манифестацијама, у савременом свијету добијају више технолошке употребе. Овај тренд се односи на једињења која постоје у природи и која их стварају људи.
Оксид
У Земљиној кори иу пространствима Универзума постоје многа хемијска једињења која се разликују по класама, типовима, карактеристикама. Један од најчешћих типова једињења је оксид (оксид, оксид). То укључује пијесак, воду, угљични диоксид, то јест основне супстанце за постојање човјечанства и цијелу биосферу Земље. Оксиди су супстанце које садрже атоме кисеоника оксидационо стање -2, док је веза између елемената бинарна. Резултат тога је њихово формирање хемијска реакција, услови који варирају у зависности од састава оксида.
Карактеристичне особине ове супстанце су три позиције: супстанца је комплексна, састоји се од два атома, један од њих је кисеоник. Велики број постојећих оксида због чињенице да многи хемијски елементи формирају неколико супстанци. Они су идентични по саставу, али атом који реагује са кисеоником показује неколико степена валенције. На пример, хромов оксид (2, 3, 4, 6), азот (1, 2, 3, 4, 5), итд. Међутим, њихова својства зависе од степена валенције елемента који улази у оксидативну реакцију.
Према прихваћеној класификацији, оксиди су базични и кисели. Такође се ослобађа амфотерна врста, која показује својства основног оксида. Кисели оксиди су једињења неметала или елемената са високом валенцијом, њихови хидрати су киселине. Главни оксиди обухватају све супстанце које имају везу кисеоник + метал, њихови хидрати су базе.

Цхроме
У 18. веку, хемичар И. Г. Лехманн открио је непознати минерал, који се звао црвени сибирски олов. Професор Паришке школе за минералогију, Вокелен, провео је низ хемијских реакција са добијеним узорком, због чега је изолован непознати метал. Главне особине које је научник идентификовао постале су његова отпорност на киселе средине и ватросталну (отпорност на топлоту). Име "хром" (Цхромиум) настало је због широке палете боја, коју карактеришу једињења елемента. Метал је прилично инертан, у чистом облику се не јавља у природним условима.
Главни минерали који садрже хром су: хромит (ФеЦр 2 О 4 ), меланохроит, вокеленит, дитез, тарапакаит. Хемијски елемент Цр налази се у шестој групи периодичног система ДИ Менделеев, има атомски број 24. Електронска конфигурација атома хрома омогућава елементу да има валенцију +2, +3, +6, са најстабилнијим једињењима тровалентног метала. Могуће реакције у којима је степен оксидације +1, +5, +4. Хром није хемијски активан, метална површина је покривена филмом (ефекат пасивизације), што спречава реакцију са кисеоником и водом у нормалним условима. Хромов оксид, који се формира на површини, спречава метал у интеракцији са киселинама и халогенима у одсуству катализатора. Једињења са једноставним супстанцама (не метали) могућа су на температури од 300 ° Ц (хлор, бром, сумпор).
У интеракцији са комплексним супстанцама, потребни су додатни услови, на пример, са алкалним раствором, реакција се не дешава, са њеним топљењем процес је веома спор. Хром реагује са киселинама када постоји висока температура као катализатор. Хромов оксид се може добити из различитих минерала излагањем температури. У зависности од будућег степена оксидације елемента, користе се концентроване киселине. У овом случају, валенција хрома у једињењу варира од +2 до +6 (виши оксид хрома).

Апплицатион
Због јединствених антикорозивних својстава и отпорности на топлоту, легуре на бази хрома су од велике практичне важности. У исто време, као проценат, његово учешће не би требало да пређе половину укупног обима. Велики недостатак хрома је његова крхкост, што смањује могућности обраде легура. Најчешћи начин употребе метала је прављење премаза (хромирање). Заштитни филм може бити слој од 0,005 мм, али ће поуздано заштитити метални производ од корозије и вањских утјецаја. Једињења хрома се користе за производњу топлотно отпорних конструкција у металуршкој индустрији (пећи за топљење). Антикорозивни премази декоративног правца (метална керамика), специјални легирани челик, електроде за апарате за заваривање, легуре на бази силицијума, алуминијум су тражене на светском тржишту. Хромов оксид због ниске могућности оксидације и високе отпорности на топлоту служи као катализатор за многе хемијске реакције које се одвијају на високим температурама (1000 о Ц).

Бивалентна једињења
Хромов оксид (2) ЦрО (азотни оксид) је прах јарко црвене или црне боје. У води је нерастворљив, под нормалним условима не оксидује, показује изражене основне особине. Супстанца је чврста, ватростална (1550 о Ц), није токсична. У процесу загревања на 100 ° Ц, оксидује се у Цр 2 О 3 . У слабим растворима азотне и сумпорна киселина не раствара, реакција се одвија са хлороводоничном киселином.

Пријем, апликација
Ова супстанца се сматра нижим оксидом. Има прилично уски опсег. У хемијској индустрији, хром оксид 2 се користи за пречишћавање угљоводоника из кисеоника, који га привлачи током оксидације на температурама изнад 100 о Ц. Постоје три начина за добијање бивалентног хромовог оксида:
- Разлагањем карбонил Цр (ЦО) 6 у присуству високе температуре као катализатора.
- Ресторинг витх фосфорна киселина хромов оксид 3.
- Хромов амалгам се оксидира кисеоником или азотном киселином.
Тривалентна једињења

За оксиде хрома, степен оксидације +3 је најстабилнији облик супстанце. Цр 2 О 3 (хромна зеље, сесквиоксид, есколид) је хемијски инертан, нерастворљив у води, има високу тачку топљења (више од 2000 о Ц). Хром оксид 3 - зелени ватростални прах, веома чврст, има амфотерна својства. Супстанца је растворна у концентрованим киселинама, а реакција са алкалијама настаје као резултат фузије. Може се редуковати до чистог метала у интеракцији са јаким редукционим средством.
Припрема и употреба
Због високе тврдоће (упоредиве са корундом), употреба супстанце у абразивним и полирним материјалима је најчешћа. Хромов оксид (формула Цр 2 О 3 ) има зелену боју, па се користи као пигмент у производњи стакла, боја, керамике. За хемијску индустрију, ова супстанца се користи као катализатор за реакције са органским једињењима (синтеза амонијака). Тривалентни хромов оксид се користи за стварање вештачких драгог камења и спинела. За добијање коришћених неколико типова хемијских реакција:
- Оксидација хромовог оксида.
- Загревање (калцинисање) дихромата или амонијум хромата.
- Разлагање тровалентног хромидног хрома или хексавалентног оксида.
- Калцинација живиног хромата или бикромата.
Хексавалентна једињења
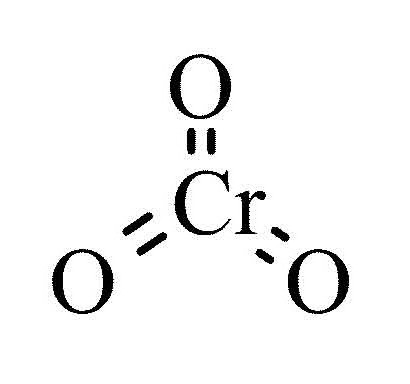
Формула за виши оксид хрома је ЦрО 3 . Супстанца је љубичасте или тамно црвене боје, може постојати у облику кристала, иглица, плоча. Хемијски активан, токсичан, у интеракцији са органска једињења постоји опасност од спонтаног сагоревања и експлозије. Хромов оксид 6 - хромни анхидрид, хром триоксид - је високо растворљив у води, у нормалним условима је у интеракцији са ваздухом (замућеност), тачка топљења је 196 о Ц. Супстанца има изражене киселинске карактеристике. Када се хемијска реакција са водом формира дихромном или хромном киселином, без додатних катализатора ступа у интеракцију са алкалијама (жути хромати). За халогене (јод, сумпор, фосфор) је јако оксидационо средство. Као резултат загревања изнад 250 ° Ц, формирају се слободни кисеоник и тровалентни хромов оксид.

Како доћи и гдје се користи
Хромов оксид 6 се добија третирањем натријумових или калијум хромата (бикромата) са концентрованом сумпорном киселином или реакцијом сребрног хромата са хлороводоничном киселином. Висока хемијска активност супстанце одређује главне правце њене употребе:
- Добијање чистог метала - хрома.
- У процесу хромирања површина, укључујући и електролитичке методе.
- Оксидација алкохола (органских једињења) у хемијској индустрији.
- У ракетној технологији се користи као упаљач.
- У хемијским лабораторијама чисти јела од органских једињења.
- Користи се у пиротехничкој индустрији.