Фибриларни протеин: структура, примери
У смислу њиховог преклапања у тродимензионалном простору, разликују се двије велике групе протеина: глобуларне и фибриларне. Већина протеина припада првој фракцији, која одговара типичном моделу терцијарне структуре, описујући ланац аминокиселина као сферни заплет са хидрофобним центром и хидрофилном површином. Влакнасти протеини су специфична група коју карактерише филаментни облик молекула.
Опште карактеристике просторне структуре протеина
У свом првобитном облику, синтетизовани протеин је линеарни ланац аминокиселина повезаних заједно пептидним везама. Међутим, на путу до коначне функционалне форме, молекул пролази кроз неколико фаза просторног преклапања због различитих хемијских интеракција. Свака фаза формирања одређена је одговарајућим структурама: примарним, секундарним, терцијарним и квартарним (ако их има).
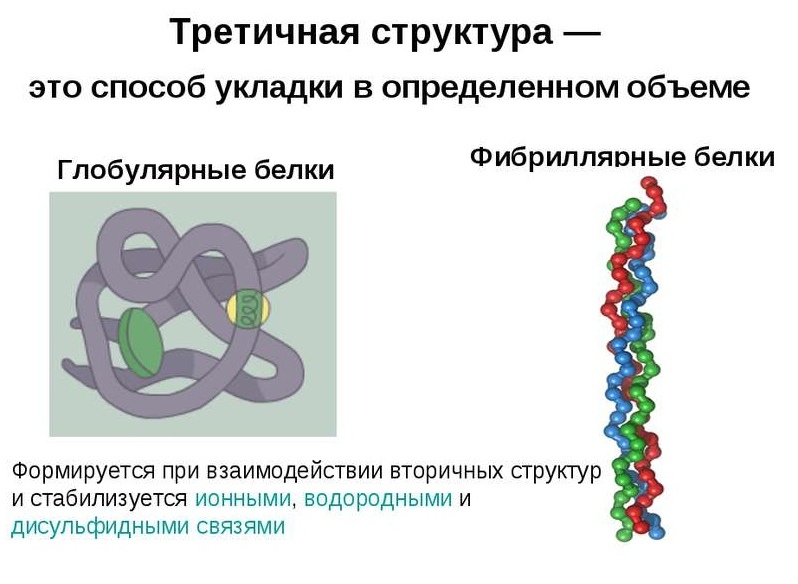
Кугласти протеини су карактерисани тродимензионалном просторном конформацијом, коју задржава комплекс слабих хемијских веза (водоник, јонски, хидрофобни, итд.). Облик молекула таквог протеина подсећа на сферни сплет.
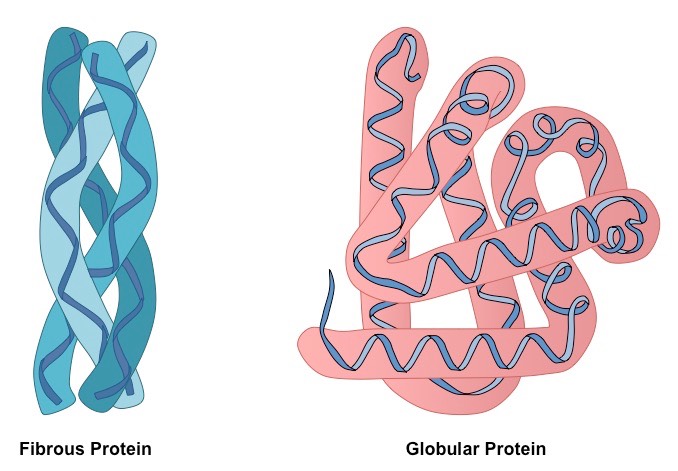
Полипептидни ланци фибриларних протеина формирају дуга влакна, која се састоје од репетитивних елемената секундарне структуре. Уређај терцијарне конформације филаментозних протеина у односу на глобулу је много примитивнији, али пружа добру стабилност.
Главне разлике филаментозних протеина од сферних
Поред просторне форме, фибриларни протеини се разликују од глобуларних у:
- сизе;
- растворљивост;
- функције.
Влакнасти протеини су обично већи од сферних и дуги су штапићи формирани од спирала. За разлику од глобуларних протеина, просторна конформација фибриларних протеина обезбеђена је јаким водоничним везама. Из тог разлога, фиброзни протеини су стабилнији и нису тако лако денатурирани као сферични.
За разлику од глобуларних протеина, фибриларни:
- није растворљив у води, као и слабе киселине и базе;
- растворљив у јаким алкалијама и киселинама;
- поседују својства растезљивости и компресије;
- карактерише висока отпорност на дигестивне ензиме.
Кугласти протеини изграђени су из равних секција секундарних структура, које, када се комбинују једна са другом, драматично мењају правац, формирајући тродимензионални сплет. Влакнасти протеини се састоје од једног елемента, који се понавља много пута.
Карактеристике фибриларних протеина
Различити фибриларни протеини су значајно мањи од глобуларних. Ова група је специјализована фракција протеина који обављају примарно структурне функције. У овом случају, фибриларни протеини раде на макро нивоу, формирајући велике супрамолекуларне комплексе.
Влакнасти протеини су идентификовани само код животиња. Ови протеини врше функцију потпорних компоненти неких ткива. Таква биолошка улога намеће повећане захтјеве на снагу и уредност конструкције молекула. Из тог разлога, фибриларна структура протеина је стабилнија од глобуле.
Влакнасти протеини су укључени у формирање крутих структура, као што су:
- везивно ткиво;
- тетиве;
- мишићна влакна.
Ови протеини су део разних површинских формација (епидерма, коса, вуна, итд.), Који обављају заштитне функције.
У природном физиолошком окружењу, фибриларни протеини нису присутни у раствору. Међутим, ако вештачки мешате влакнасте протеинске молекуле са водом, формира се веома вискозна маса.
Примери фибриларних и глобуларних протеина
Кугласти протеини обухватају све протеине растворене у међустаничном и интрацелуларном медију, као иу крвној плазми. Ту спадају ензими, протеински хормони, фактори транскрипције, имуноглобулини и тако даље. Класичан пример глобуларног протеина може се назвати хемоглобин.
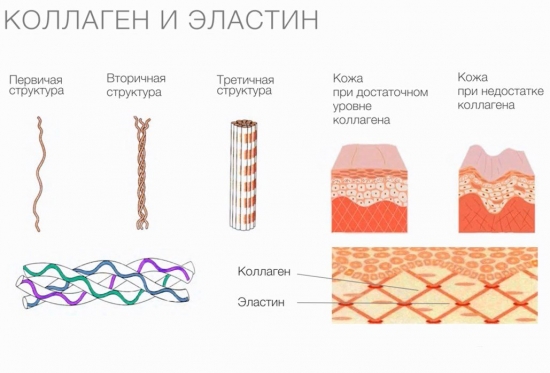
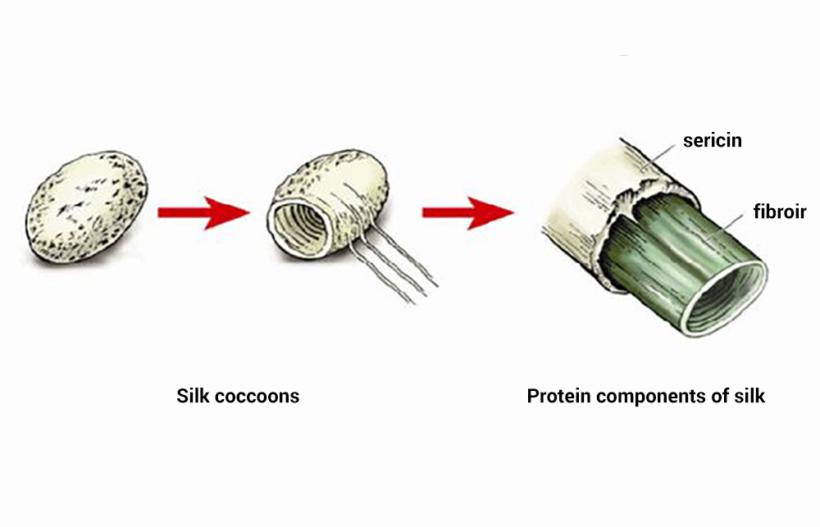
Сферни протеини обављају многе функције, док влакнасти протеини - само структурни. Типични примери фибриларних протеина су колаген, еластин и кератини. У групу влакнастих протеина спада и фиброин, који се састоји од свилене нити, и фибрин који се формира током полимеризације фибриногена у процесу згрушавања крви.
Колаген
Колаген је најчешћи фибриларни протеин вишећелијских животиња. Он је део везивног ткива, осигуравајући његову јачину и еластичност. Овај протеин је присутан у:
- хрскавица;
- дермис;
- тетиве;
- органска коштана матрица;
- зидови посуда;
- органски коштани материјал.
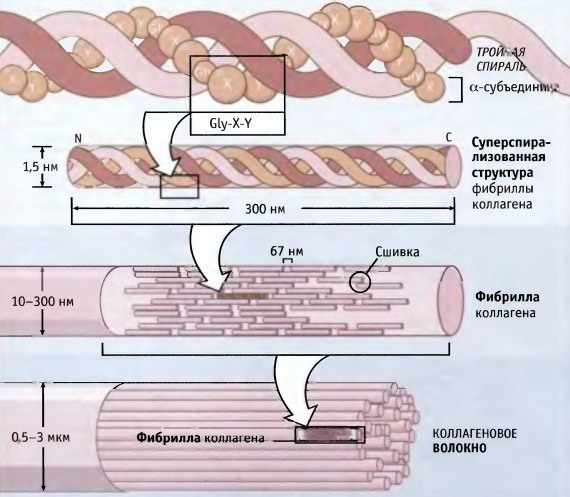
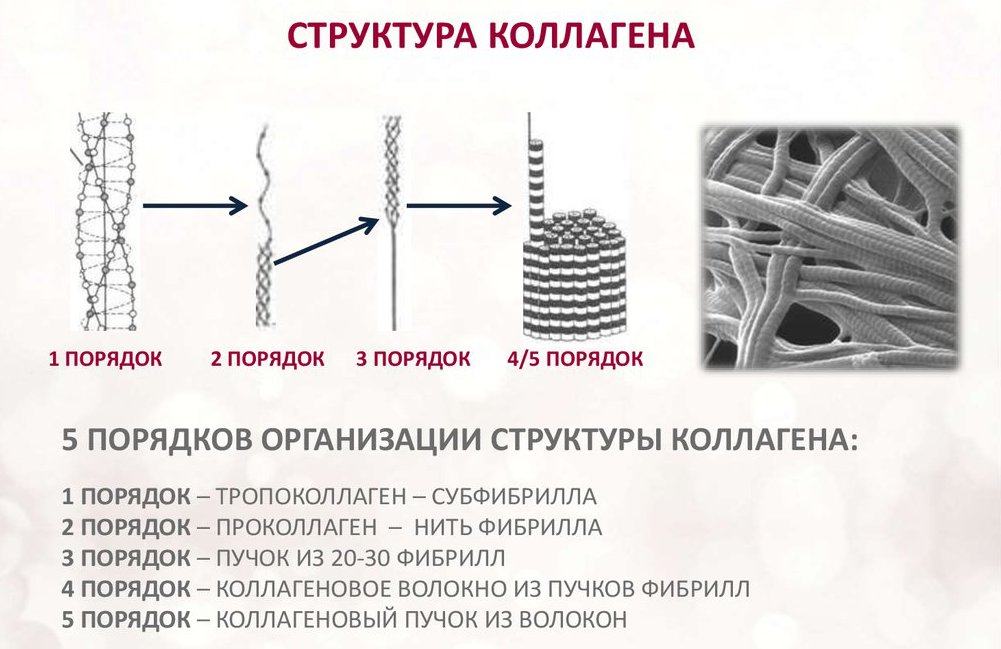
Колаген се састоји од три ланца аминокиселина уплетених у спиралу и међусобно повезаних ковалентним везама. Структурне јединице овог протеина називају се тропоколагени. Потоњи су међусобно повезани крајевима који су међусобно одмакнути на удаљености од 67 нанометара.
У зависности од локализације у телу, постоји 28 врста колагена. Све сорте морају имати најмање једну троструку хеликсну домену. Колаген је основа свих врста везивног ткива. Структурне компоненте овог протеина формирају врло јаке фибриле које су у стању да издрже знатна оптерећења.
Колаген врши функције подршке и заштите, као и еластичност ткива. Међутим, молекули овог протеина немају способност растезања. Карактеристике гуме карактеристичне су за други протеин, такође присутан у везивном ткиву, еластину.
Кератинс
Постоје 2 главна типа кератина: алфа и бета. Прву групу чине фиброзни протеини који су део покривних формација кичмењака. Алфа кератини чине већину суве масе:
- епидермис;
- коса и вуна;
- канџе и нокте;
- копита, рогови, шкољке, игле итд.
Другим речима, кератини алфа групе су структурна основа за формирање деривата коже. Бета варијанта овог типа влакнастог протеина налази се у саставу мреже и свиле. Ови кератини су мекши.
Тешки алфа-групни протеини имају заштитне функције и осигуравају снагу одређених анатомских дијелова (рогови, копита, кљунови). Због кератина долази до формирања жуљева на оштећеној кожи.
Еластин
Еластин је главна протеинска компонента ткива која треба да има високе пластичне особине. Овај протеин је део:
- артерије;
- плућа;
- зидови бешике;
- кожа;
- еластични лигаменти;
- хрскавице.
Као и други фибриларни протеини, еластин је изграђен од елементарних понављајућих јединица. У овом случају, они делују као мали молекули тежине 65 килодалтона, који су умрежени тако да формирају нерастворни комплекс. Свака структурна јединица назива се протоеластин.