Како одредити степен оксидације: периодни систем и алгоритам дјеловања
Како одредити степен оксидације? Периодни систем вам омогућава да снимите ову количину за сваки хемијски елемент.
Дефиниција
За почетак, покушајмо да схватимо шта је овај термин. Стање оксидације према периодној табели, он представља број електрона који се прихватају или дају од стране елемента у процесу хемијске интеракције. Може имати негативну и позитивну вриједност.

Линк то табле
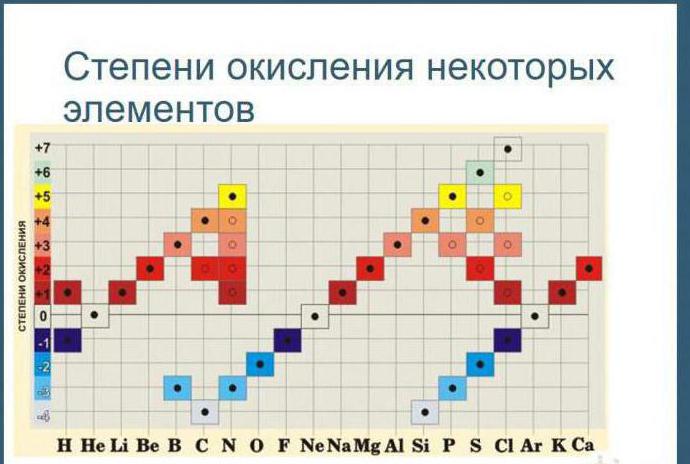
Како се одређује степен оксидације? Периодни систем се састоји од осам група постављених вертикално. У свакој од њих постоје двије подгрупе: главна и секундарна. Да би се поставили индикатори за елементе, потребно је користити одређена правила.
Инструкција
Како израчунати степен оксидације елемената? Табела вам омогућава да се потпуно носите са овим проблемом. Алкали метали који се налазе у првој групи (главна подгрупа), степен оксидације се манифестује у једињењима, одговара +, једнак је њиховој вишој валенцији. Метали друге групе (подгрупа А) +2 оксидационог стања.
Ова табела вам омогућава да одредите ову вредност не само за елементе који показују метална својства, већ и за неметале. Њихова максимална вредност ће одговарати највишој валенцији. На пример, за сумпор ће бити +6, за азот +5. Како се израчунава минимална (најнижа) бројка? Табела одговара на ово питање. Потребно је одузети број групе од осам. На пример, у кисеонику ће бити -2, у азоту -3.
За једноставне супстанце које не улазе у хемијску интеракцију са другим супстанцама, индекс који се утврђује сматра се нула.
Покушајмо да идентификујемо главне акције које се тичу аранжмана у бинарним једињењима. Како ставити у њих степен оксидације? Периодни систем помаже у рјешавању проблема.
На пример, узмите калцијум оксид Цао. За калцијум, који се налази у главној подгрупи друге групе, вредност ће бити константа једнака +2. За кисеоник који има неметална својства, овај индикатор ће бити негативна и одговара -2. Да бисмо проверили исправност дефиниције, сумирамо добијене бројеве. Као резултат, добијамо нулу, дакле, калкулације су тачне.
Сличне индикаторе дефинишемо у другом бинарном једињењу ЦуО. Пошто се бакар налази у секундарној подгрупи (прва група), индикатор који се разматра може показивати различите вредности. Стога, да бисте то утврдили, прво морате да идентификујете индикатор за кисеоник.
У неметалу који се налази на крају бинарне формуле, степен оксидације има негативну вредност. Пошто се овај елемент налази у шестој групи, при одузимању од осам шест, добијамо да оксидационо стање кисеоника одговара -2. Пошто нема индекса у једињењу, индекс оксидације бакра ће бити позитиван, једнак +2.
Како се другачије користи хемијски стол? Степен оксидације елемената у формулама које се састоје од три елемента такође се израчунава специфичним алгоритмом. Прво, поставите ове индикаторе у први и задњи елемент. За први, овај индикатор ће имати позитивну вриједност, одговара валенцији. На екстремном елементу, који служи као неметални, овај индикатор има негативну вриједност, дефинира се као разлика (број групе се узима из осам). При израчунавању степена оксидације централног елемента користи се математичка једнаџба. У израчунима се узимају у обзир индекси који су доступни за сваки елемент. Збир свих оксидационих стања мора бити нула.
Пример одређивања у сумпорној киселини
Формула за ово једињење је Х2С04. У водонику, оксидационо стање ће бити +1, у кисеонику је -2. Да бисмо одредили степен оксидације у сумпору, направили смо математичку једначину: + 1 * 2 + Кс + 4 * (-2) = 0. Добијамо да степен оксидације сумпора одговара +6.
Закључак
Када се користе правила, можете уредити коефицијенте у редокс реакцијама. Ово питање је обрађено на деветом разреду хемије у школском курикулуму. Поред тога, информације о степенима оксидације вам омогућавају да извршите задатке ОГЕ и ЕГЕ.