Сенф гас: име, формула, карактеристике и занимљивости о супстанци
Први хемијски напад у историји извршен је 22. априла 1915. године од стране немачких трупа у близини белгијског града Ипр. У квалитету отровна супстанца У то време коришћен је хлор, који је постао први тип хемијског оружја. Након првог напада уследио је други, 31. маја исте године, на источном фронту, користећи фозген. 12. маја 1917., након још неколико епизода успешне употребе других токсичних супстанци (агенаса), поново је извршен хемијски напад у близини Ипреса - употребом сенфа, касније названог "сенф" на бојном пољу.

Хистори оф
Домовина сенфа се може сматрати Белгијом. Њен домаћи физичар Цесар Депре је први пут 1822. године синтетисао ову супстанцу. Добио је сенф гас када је био изложен етилен сумпор хлориду (сумпор дихлорид). Горчицу од сенфа је такође набавио Рицх у 1854, а Фредерицк Гутхрие 1860. користећи исте реагенсе. Он је у свом истраживању већ говорио о штетном утицају гаса.
Први пут је чисти сенф добијен од стране немачког научника Виктора Мејера. Уместо директне синтезе, користио је тиодигликол и фосфор триклорид. Меиер је детаљно описао физичка и хемијска својства овог једињења.

Током Првог светског рата и после њега, Ломмел и Стеинкопф су проучавали гас (тада се појавио оригинални назив ове супстанце, Лост). Захваљујући њиховим истраживањима, Немачка је била у могућности да примени Лост већ 1917. године. Употребљени поступак приправе био је исти као и код Меиер-а, употребљен је само тионил хлорид уместо трихлорида угљеника.
Након гасних напада, државе Антанте су схватиле ефикасност сенфа и након неког времена почеле су и производњу.
У Гуиллер'с Германи, производња сенфа је била од велике важности: количина произведеног ОМ-а је мјерена у стотинама хиљада тона. Њено уништење након рата трајало је око десет година.
Вредност и користи
Пре сенфа, Немци су користили отровни хлор и загушљив фосген / дифосген (као и њихове мешавине у различитим пропорцијама) - гасовити ОМ. За сву њихову ефикасност, имали су и недостатке: зависност од метеоролошких услова, тешкоће са испоруком и инсталацијом плинских боца, лоше контролисани радијус оштећења. Изумом муниције за артиљеријско испаљивање са средствима, постало је могуће користити отровне супстанце у било ком агрегатном стању: течном, чврстом, гасовитом. Овде се налазе чврста једињења са арсеном. Међутим, земље Антанте су брзо побољшале гас маске и ови агенти су постали неефикасни.

Појавом сенфа, почела је нова фаза у развоју органске материје. Главна карактеристика Изгубљеног гаса била је акција која је изазвала жуљење коже - осим респираторних органа, захватила је и очи и подручја тела, пробијајући се испод одеће и обуће, а не користећи гас маске. Поред тога, сенфни гас је имао ниску волатилност - дозволио је да "зарази" не живу силу, већ читаве делове терена.
Због овог низа предности у односу на друге хемијске агенсе прве генерације, сенф гас је дуго остао "у употреби", његова производња у великим количинама одвијала се до средине КСКС века.
Структура
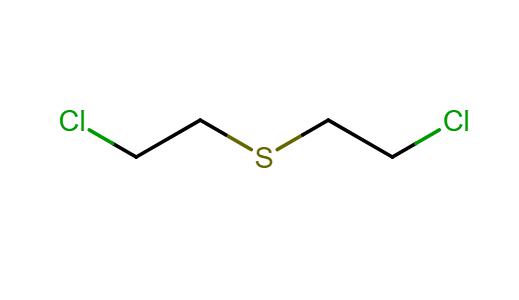
Систематски назив сенфа је 2,2'-диклородиетилсулфид. У Енглеској и Сједињеним Државама, то се зове "сенф гас" због карактеристичног каустичног мириса чешњака. У Немачкој је гас добио кодна имена Х (за техничке), ХС и касније ХД - за дестиловану супстанцу.
Формула сенфа је релативно једноставна.
Пхисицал пропертиес
У нормалним условима (атмосферски притисак, температура 20 ° Ц) сенф гас је испарљива уљана течност. Карактеристичан мирис и жућкаста боја дају нечистоће. Не раствара се у води, већ хидролизује (разлаже) да би се формирао тиодигликол. Ограничен је у алкохолу, ау органским растварачима - етер, бензен, хлороформ, животињска и биљна уља - веома добро. Такође је високо растворљив у другим хемијским агенсима, што вам омогућава да направите мешавине неколико супстанци.
Хемијска својства и неутрализација
Иако је раније у тексту наведено да се отровни сенф гас подвргава хидролизи у води, у пракси се често уочава следеће: сенф, складиштен неколико година у неповољним условима, у влажним просторијама или у оштећеним цилиндрима, изгубио је мало своје активности. Ово не одговара лабораторијским подацима: ако се супстанца хидролизује, она престаје да постоји у својој оригиналној молекуларној (за гас) форми и губи своја својства. Ова контрадикција се објашњава чињеницом да вода и сенф нису мешљиве течности: интензивно мешање се одвија у лабораторији током хидролизе, а реакција пролази кроз целокупну запремину, а у пољским условима вода прекрива слој сенфа, а реакција се одвија само на граници два медија, и то је изузетно споро и реверзибилно.
За дегазацију (неутрализацију) сенфа у великим количинама бјелила, у заједничком "избјељивачу" је од посебне важности. Нанесите га у облику концентрованог воденог раствора, у којем су инфицирани заражени објекти, темељито измијешани. Хипоклорити су економски најповољнији: јефтини су и производе се у великим количинама.

Последњих деценија, хлорамини су постали важни за отплињавање отровног сенфа. Хлорамин Т је један од најважнијих у практичној примени.У поређењу са комплексним ефектом избељивача на сенф, реакција са натријумовом соли хлорамина Т је једноставна: сумпор у дихлородиетил сулфиду се оксидира и настаје производ додавања хлорамина. На бази хлорамина Т у САД, створена је мјешавина која је погодна за отплињавање чак и инструмената и аутомобила.
Преостале смеше за отплињавање, мада могу бити ефикасније, имају само ограничену примену у пракси због високе цене сировина и сложености производње.
Једна од квалитативних реакција, која омогућава да се детектује 10 мг сенфа у 1000 литара ваздуха, је реакција са златним (ИИ) хлоридом, који се карактерише појавом жућкастог талога у раствору хлорида и високим концентрацијама сенфа, црвенкасто-жутих уљних капљица.
Геттинг
Постоје три главна начина за производњу сенфа у лабораторији и на индустријском нивоу.
Први је реакција етилена са сумпор дихлоридом. Овај метод је развио Гутхрие.
Други метод је открио Меиер и састојао се од дејства на тиодигликол средствима за хлорисање: фосфор хлориди, хидрохлорид, тионил хлорид.
Трећи метод је 1942. године развио Лазиер у САД. Заснован је на интеракцији водоник сулфида са винил хлоридом у присуству органских пероксида као катализатора. Принос производа може да достигне 75% - то је висока вредност за органску синтезу.
Акција на телу
Сенф гас је отровни и жестоки тровни агенс. Делује на све делове тела, па зато да би се заштитила од њега потребна је посебна одећа, која покрива целу површину тела.
Сенф мора имати латентни период дјеловања, тј. Одмах након контакта с кожом, неће бити симптома, а тек након 2-6 сати појављује се црвенило, упала - епидермис се одбацује. Епидермис одумире, а на његовом месту се појављују супурација и чиреви, што захтева продужени третман. Ако не постоји такав третман, смрт наступа између неколико сати и једног мјесеца (овисно о дози агенса).
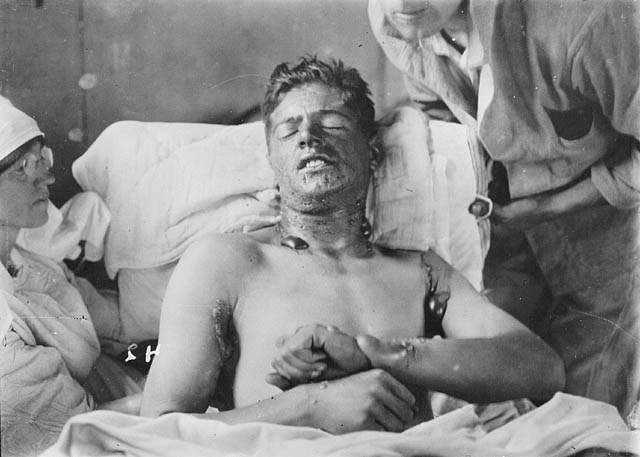
Када сенф у контакту са очима, почиње упала предњег дела ока, посебно рожњаче (могуће је чак и губитак вида због замућења). Затим се развијају гнојни коњунктивитис и некроза ткива, што захтева дуготрајно лечење.

Учинак сенфа на респираторни систем је локализован у горњем респираторном систему. Појављује се унутрашње крварење, појављују се гнојни и гангренозни жаришта, ау високим концентрацијама може се развити плућни едем.
Општи ефекат тровања сенфа је због тога што не само да је у интеракцији са погођеним подручјима, већ се апсорбује у крвоток и шири се по целом телу, што се манифестује поремећајима циркулације, токсичним бубрежним, гастроинтестиналним и церебралним крварењем.
Модификације засноване на сенфу
Познато је да су прије Другог свјетског рата и за вријеме њега, војне кемијске лабораторије у САД и Енглеској биле ангажиране у Левинстеин ипериту, мјешавини обичног сенфог плина с полисулфидима, чија је структура садржавала дуге ланце атома сумпора. Тешко је проценити војни значај ове супстанце.
После Првог светског рата, већ поменути Стеинкопф је добио дибром- и дијод-диетилсулфиде (такозвани бром-изгубљен и изгубљен јод). Оне нису добиле широку примену, јер оне у односу на ефикасност одговарају конвенционалном гасу и много су скупље у производњи.