Паули принцип у физици и хемији: карактеристике апликације
Историја атомске физике има много успона и падова. Али захваљујући техничком напретку, свака претпоставка која је настала у умовима теоретичара могла би се тестирати у лабораторији. Пошто многи аспекти понашања елементарних честица још увијек нису подложни законима логике, научници-откривачи микросвијета су се сложили да их прихвате "какви јесу", без објашњавања разлога. Принцип Паули се односи на резултате оних експеримената који још нису пронашли своје једино објашњење.
Контрадикције у теорији атома
Једна од најчешћих заблуда у атомској физици био је планетарни модел атома који је предложио енглески научник. Ернест Рутхерфорд. На крају, испоставило се да није потпуно поуздана, али је омогућила да се извуче толико тачних закључака да су њене користи неупитне. 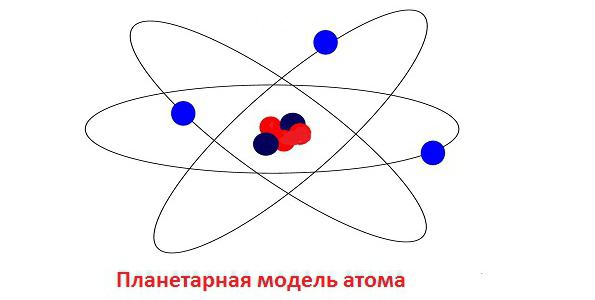 Једна од главних контрадикција Рутхерфордовог атома била је способност електрона до зрачења. Као резултат губитка енергије, сваки електрон је на крају морао да заустави своје кретање и падне у нуклеус. Али сваки атом (осим радиоактивног) је инхерентно стабилан, може постојати арбитрарно дуго и не показује никакве знакове самоуништења. Да би решио овај проблем, он је искористио таленат бриљантног данског физичара Ниелса Бохра.
Једна од главних контрадикција Рутхерфордовог атома била је способност електрона до зрачења. Као резултат губитка енергије, сваки електрон је на крају морао да заустави своје кретање и падне у нуклеус. Али сваки атом (осим радиоактивног) је инхерентно стабилан, може постојати арбитрарно дуго и не показује никакве знакове самоуништења. Да би решио овај проблем, он је искористио таленат бриљантног данског физичара Ниелса Бохра.
Бохрова теорија
Године 1913. млади непознати физичар из Данске предложио је да укључи двије промјене у класичну физику, с којима је било могуће објаснити чињенице опажања и направити многа корисна открића. Бохр није могао објаснити узрок понашања електрона у орбити, па је принцип "као што је" стављен у основу његових правила. Ова правила су касније послужила као добра услуга и отворила пут за нова открића.
Бохр рулес

Прво правило је било то планетарни модел атома, предложио Рутхерфорд је и даље тачан. Међутим, електрони се крећу у својим орбитама без зрачења. Друго правило Бохра каже да је кретање електрона могуће само уз одређене "дозвољене" орбите. За електрон који се креће дуж дозвољене орбите, продукт импулса и полупречник ове орбите увек је вишеструк од Планкове константе. Дакле, електронске орбите могу бити лоциране само на њима енергетским нивоима за које важи следеће правило:
(електронски момент * обим орбите) = н * х,
где је х константна даска, а н је природни број. Тако, са најмање дозвољене орбите, н = 1. Треће правило каже да се електрони атома могу померити (на пример, бомбардирајући их тешким честицама) на слободну спољашњу орбиту. Након тога, електрон је у стању да се врати на слободну унутрашњу орбиту. У овом случају, атом емитује вишак енергије у облику кванта светлости.
Куантум лимитс
Борово квантно правило претпоставља да електрони који су најближи нуклеусу имају најмању дозвољену орбиту. На овом нивоу, електрон има минималну енергију. Могло би се очекивати да би сви електрони у атому морали да заузму ову орбиту и да остану на том нивоу. Међутим, то се не догађа. Принцип Паули је помогао да се објасни ова контрадикција.
Волфганг паули
Овај чувени аустријски физичар рођен је у Бечу 1869. године. На Универзитету у Минхену, добио је одлично образовање, али је посветио све своје научне радове квантној физици. Са двадесет година, Паули је написао прегледни чланак за Физичку енциклопедију, чије су многе странице и данас релевантне. Његови научни радови су ретко објављивани, његове најважније мисли и хипотезе су изражаване у кореспонденцији са његовим научним колегама. Најживље дописивање је обављено са Н. Бохром и В. Хеисенбергом. То је био заједнички рад ова три научника који су поставили темеље за темеље модерне квантне физике. На основу експерименталних података тројице истакнутих научника, Паули је формирао свој принцип. За њега је 1945. године аустријски научник добио Нобелову награду.
Електронско кретање
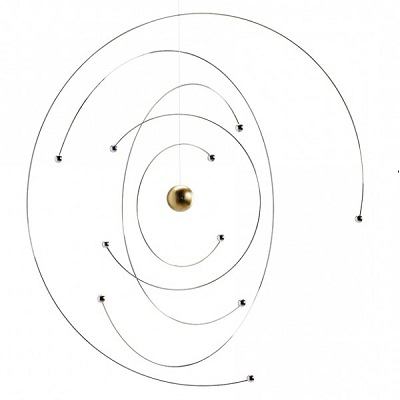
Истражујући кретање електрона, В. Паули је наишао на много чудних тренутака у понашању ове елементарне честице. На пример, електрони, када се крећу, понашају се као да се ротирају око своје осе. Прави тренутак ротације електрона назива се спин. На једном месту у орбити, могу да стану два електрона, и њихови центри треба да буду супротни. једни другима као принцип Паулија. Физика овог ограничења важи не само за електроне, већ и за друге честице са полу-целобројном спином.
Периодни систем и Паулијев принцип
Хемија је користила принцип несигурности да објасни унутрашњу структуру супстанци. Сада постаје сасвим разумљиво зашто у првом реду периодне табеле постоје само два елемента. И водоник и хелиј имају на располагању једну нижу орбиту, у којој постоји само једно дупло место за електроне са супротним спиновима. Следећа орбита садржи осам таквих места. Према томе, други ред периодичног система је био у стању да узме осам елемената. Овај образац се проширује на све серије периодичног система. 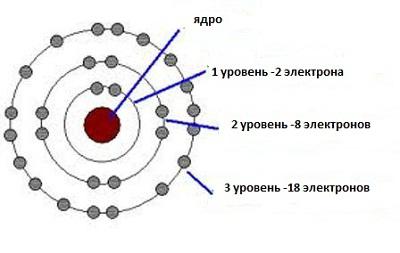
Физика звезда
Чудно је да се закони понашања елементарних честица протежу далеко изван микросвијета. На пример, физика звезда се бави унутрашњим светом звезда старења. Принцип Паулија функционише овде, само што се он схвата мало другачије. Ово правило каже да у одређеном просторном волумену постоји могућност да се смести само на две елементарне честице са супротним спиновима. Посебно је јасно да овај закон важи када се посматрају старије звијезде. Као што је познато, након експлозије, звезда супернове се брзо сруши, али не све звезде се претварају у црне рупе. Са повећањем прага граничне густине (и за стару звезду, ова вредност је реда величине 10 7 кг / м3), унутрашњи притисак космичког тела се убрзано повећава. Овај процес има посебан научни термин - притисак дегенерисаног електронског гаса. Дакле, звезда престаје да губи волумен и претвара се у мало небеско тело величине наше Земље. Такве звезде у астрофизици називају се бијели патуљци.
Резултати
Принцип несигурности је један од првих закона новог типа, који се разликује од свих идеја о свијету око којег знамо. Нови закони се фундаментално разликују од правила класичне физике која нам је позната од детињства. Ако су стара правила говорила о томе шта се може догодити када се предузму одређене акције, онда закони новог типа указују да се нешто не би требало десити.

Алгоритми за решавање многих проблема морају бити засновани на благо модификованом Паулијевом принципу. Прекидајући на самом почетку немогућа решења проблема, постоји шанса да се пронађе једини тачан одговор. Практична употреба принципа несигурности значајно смањује вријеме потребно за компјутерску обраду информација. Претходно познат само у кругу теоретских физичара, Паулијев принцип је одавно прешао границе квантне физике, означавајући тиме нове методе за проучавање природних закона.