Који је број Авогадра?
Авогадро лав Постао је прави пробој у теоријској хемији и допринео чињеници да су се хипотетичке претпоставке претвориле у велика открића у области гасне хемије. Претпоставке хемичара су добиле убедљиве доказе у облику математичких формула и једноставних односа, а резултати експеримената сада су омогућили доношење далекосежних закључака. Поред тога, италијански истраживач је извео квантитативни опис броја структурних честица хемијског елемента. Авогадров број је касније постао једна од најважнијих константи модерне физике и хемије. 
Закон волуметријских односа
Част да буде откривач гасних реакција припада Гаи-Луссац-у, француском научнику с краја КСВИИИ века. Овај истраживач дао је свету добро познати закон који регулише све реакције везане за ширење гасова. Гаи-Луссац је мјерио волумене гасова прије реакције и волумене који су добивени као резултат кемијске интеракције. Као резултат експеримента, научник је направио закључак познат као закон једноставних волуметријских односа. Његова суштина је да су запремине гасова пре и после повезане једна са другом као цели мали број.
На пример, интеракција гасовитих супстанци, које одговарају, на пример, једној запремини кисеоника и две запремине водоника, резултира у две запремине водене паре, и тако даље. 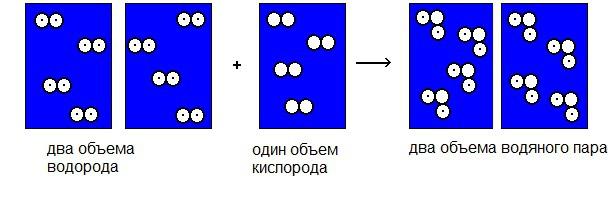
Закон Гаи-Луссац је валидан ако се сва мерења запремина одвијају под истим притиском и температуром. Овај закон је био веома важан за италијанског физичара Авогадра. Вођен од њега, он је извукао своју претпоставку, која је имала далекосежне последице у хемији и физици гаса, и израчунала Авогадро број.
Италијански научник
Његове научне активности Амедео Авогадро Почео је са проучавањем електрокемијских појава. Године 1803. представио је свој рад на теорији електрокемијских феномена који припадају Академији у Торину. Касније су његове идеје заинтересовале Ампере, који их је развио у потпуну физичку теорију, подржану бројним експериментима. Заинтересован за сва најновија открића из физике и хемије, Авогадро је био суочен са проблемом односа запремина различитих супстанци и броја молекула који се у њима налазе. Године 1811, научник је формулисао сугестију која објашњава закон Гаи-Луссац и даје нови потицај објашњењу многих. хемијске реакције.
Авогадро лав
Године 1811. Авогадро је схватио да у једнаким количинама произвољних гасова при константним температурама и притисцима садржи исти број молекула.  Овај закон, касније именован у част италијанског научника, увео је у науку идеју о најмањим честицама супстанце - молекулима. Хемија је била подељена на емпиријску науку, као што је и била, и на науку која функционише у квантитативним категоријама, које је постала. Авогадро је посебно нагласио чињеницу да атоми и молекули нису исти и да су атоми градивни блокови за све молекуле.
Овај закон, касније именован у част италијанског научника, увео је у науку идеју о најмањим честицама супстанце - молекулима. Хемија је била подељена на емпиријску науку, као што је и била, и на науку која функционише у квантитативним категоријама, које је постала. Авогадро је посебно нагласио чињеницу да атоми и молекули нису исти и да су атоми градивни блокови за све молекуле.
Закону италијанског истраживача дозвољено је да дође до закључка о броју атома у молекулима различитих гасова. На пример, након закључења закона Авогадро је потврдио претпоставку да се молекули таквих гасова као што су кисеоник, водоник, хлор и азот састоје од два атома. Такође је постало могуће утврдити атомске масе и молекуларне масе елемената који се састоје од различитих атома.
Атомске и молекуларне тежине
Приликом израчунавања атомске тежине елемента, у почетку је за јединицу мере као најлакша хемијска супстанца узета маса водоника. Али атомске масе многих хемикалија су израчунате као однос њихових једињења кисеоника, тј. Однос кисеоника и водоника је узет као 16: 1. Ова формула је била помало неугодна за мерења, тако да је маса изотопа угљеника, најчешће супстанце на земљи, усвојена као стандард за атомску масу.
Принцип одређивања масе различитих гасовитих супстанци у молекуларном еквиваленту заснива се на Авогадровом закону. Године 1961. усвојен је један референтни систем релативних атомских вредности, који је заснован на конвенционалној јединици једнакој 1/12 дела масе једног угљеничног изотопа 12 Ц. Скраћени назив атомске јединице масе је Аму. Према овој скали, атомска маса кисеоника је 15.999 аму, а она угљеника је 1.0079 аму. Тако је настала нова дефиниција: релативна атомска маса је маса атома супстанце, изражена у аму.
Маса молекула супстанце
Свака супстанца се састоји од молекула. Маса таквог молекула изражена је у ае.у.м, ова вредност је једнака збиру свих атома који чине његов састав. На пример, молекула водоника има масу од 2.0188 аму, тј. 1.0079 к 2, а молекулска маса воде се може израчунати из њене хемијске формуле Х 2 О. Два атома водоника и један атом кисеоника дају укупно 18. , 0152 аму
Вредност атомске масе за сваку супстанцу назива се релативна молекуларна тежина.
До недавно је употребљен израз "атомска тежина" уместо израза "атомска маса". Тренутно се не користи, али се још увијек налази у старим уџбеницима и научним радовима.
Јединична количина супстанце
Заједно са јединицама волумена и масе, хемија користи посебну меру количине супстанце, назване кртица. Ова јединица показује количину супстанце која садржи онолико молекула, атома и других структурних честица колико има у 12 г угљеника изотопа 12 Ц. У практичној примени мола неке супстанце, неопходно је узети у обзир који су поједини делови елемената - јони, атоми или молекули. На пример, мол Х + јона и Х 2 молекула су потпуно различите мере.
Тренутно се количина супстанце у молу супстанце мери са великом тачношћу.
 Практични прорачуни показују да је број структурних јединица по молу 6.02 к 10 23 . Ова константа се зове Авогадро број. Названа по италијанском научнику, ова хемијска вредност означава број структурних јединица у молу било које супстанце, без обзира на његову унутрашњу структуру, састав или порекло.
Практични прорачуни показују да је број структурних јединица по молу 6.02 к 10 23 . Ова константа се зове Авогадро број. Названа по италијанском научнику, ова хемијска вредност означава број структурних јединица у молу било које супстанце, без обзира на његову унутрашњу структуру, састав или порекло.
Моларна маса
Маса једног мола супстанце у хемији се назива "моларна маса", ова јединица је изражена односом г / мол. Примјеном вриједности моларне масе у пракси, може се видјети да је моларна маса водика 2.02158 г / мол, кисик - 1.0079 г / мол, и тако даље.
Последице Авогадро закона
Авогадров закон је прилично примјењив за одређивање количине твари при израчунавању количине плина. Једнак број молекула било које гасне супстанце под једнаким условима узима једнаку запремину. С друге стране, 1 мол било које супстанце садржи непромењен број молекула. Закључак показује: при константној температури и притиску један мол гасне супстанце заузима константан волумен и садржи једнак број молекула. Авогадро број наводи да запремина 1 мола гаса садржи 6.02 к 10 23 молекула.
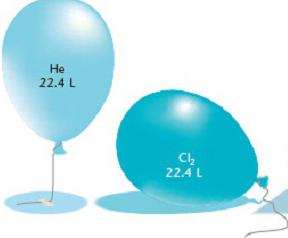
Израчунајте запремину гаса за нормалне услове
Нормални услови у хемији - то је атмосферски притисак од 760 мм Хг. Арт. и температура од 0 о Ц. Са овим параметрима, експериментално је утврђено да маса једног литра кисеоника износи 1,43 кг. Према томе, запремина једног мола кисеоника је једнака 22,4 литара. При израчунавању запремине било ког гаса, резултати су показали исту вредност. Тако је Авогадрова константа донела још један закључак у вези са количинама различитих гасовитих супстанци: у нормалним условима, један мол сваког гасовитог елемента заузима 22,4 литара. Ова константна вредност се назива моларна запремина гаса.