Шта су халогени у хемији?
Хајде да причамо о томе шта су халогени. Они су у седмој групи (главна подгрупа) периодне табеле. Преведено са грчког, "халоген" значи "рађање соли". У чланку ће се говорити о томе шта чини хемијски халоген, које се супстанце комбинују под овим термином, које су њихове особине и карактеристике производње.

Посебне карактеристике
Расправљајући о томе шта су халогени, уочавамо специфичност структуре њихових атома. Сви елементи на спољном енергетском нивоу имају седам електрона, а један од њих је неспарен (слободан). Стога су изражена оксидативна својства халогена, тј. Додавање једног електрона у интеракцији с различитим супстанцама, што доводи до потпуног завршетка вањског енергетског нивоа, формирања стабилних конфигурација халида. Са металима, они формирају чврсту супстанцу ионска веза карактер

Представници халогена
Оне укључују следеће елементе: флуор, хлор, бром, јод. Астатис и теннесин имају формални однос према њима. Да би се разумело шта су халогени, треба напоменути да хлор, бром и јод имају слободну орбиталу. Она објашњава разне ствари оксидациона стања за ове ставке. На пример, хлор има следеће вредности: -1, + 1, + 3, +5, +7. Када се атому хлора даје додатна енергија, долази до постепеног преласка електрона, што објашњава промене у степенима оксидације. Међу најстабилнијим конфигурацијама хлора су његова једињења, у којима је степен оксидације -1, као и +7.

Бити у природи
Карактеристике структуре објашњавају њихову преваленцију у природи. Халогенска једињења у природи су представљена као халиди, високо растворљиви у води. Са повећањем атомског радијуса халогена, њихов квантитативни садржај у земљиној кори се смањује. На пример, нека једињења брома, хлора, флуора се користе у индустријским количинама.
Калцијум флуорид (флуорит) може се навести као главно једињење флуора присутно у природи.
Особине пријема
Да би се разумело шта су халогени, потребно је сазнати како их добити. Главна опција за изолацију чистих халогена из соли је електролиза растаљених соли. На пример, када сте изложени натријум хлорид директна електрична струја као реакциони производи могу се сматрати не само плиновитим клором, већ и металним натријумом. На катоди се редукује метал, а на аноди се формира халоген. За добијање брома употребом морске воде проводи се електролиза овог раствора.
Пхисицал пропертиес
Осврнимо се на физичке особине представника седме групе главне подгрупе. Флуор у нормалним условима је гасовита супстанца која има светло жуту боју, оштар и иритантан мирис. Гасовити и жуто-зелени хлор, са оштрим гушењем. Бром је тешка течна течност. Од свих халогена, само јод је љубичаста кристална супстанца.
Флуор је најјачи оксидациони агенс. У групи, способност везивања електрона током хемијске реакције постепено се смањује од флуора до астата. Разлог слабљења ове особине је повећање атомског радијуса.
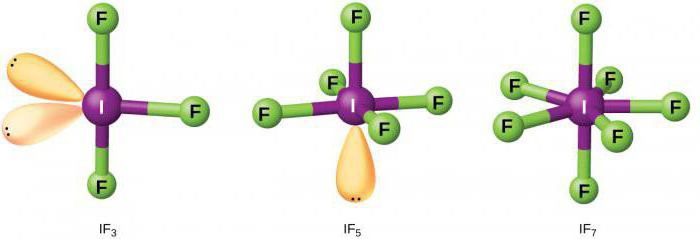
Карактеристике хемијских својстава
Флуор, као најјачи оксидациони агенс, може реаговати без додатног загревања са скоро свим неметалима. Процес је праћен ослобађањем велике количине топлоте. Код метала, процес се карактерише самозапаљивањем флуора.
Пошто се овај халоген одликује високом хемијском активношћу, он је у стању да реагује када је изложен племенитим гасовима.
Флуор реагује са комплексним супстанцама. Активност брома је значајно нижа. Углавном се користи у органској хемији за спровођење квалитативних реакција на незасићена једињења.
Јод је у интеракцији са металима само када се загрева, а процес карактерише апсорпција енергије (егзотермна реакција).
Особине употребе
Која је вредност халогена? Да бисте одговорили на ово питање, размотрите главне области њихове примјене. На пример, природни минерал цриолите, који је једињење алуминијума, флуора, натријума, користи се као адитив у пасти за зубе како би се спречило пропадање зуба.
Хлор у великим количинама се користи у производњи хлороводоничне киселине. Поред тога, овај халоген је тражен у производњи пластике, растварача, боја, гума, синтетичких влакана. Велика количина једињења која садрже хлор се користи за ефикасно сузбијање разних штеточина пољопривредних култура. Хлор, као и његова једињења, такође су неопходни за бељење памучне и ланене тканине, папира и дезинфекцију воде за пиће. Бром и јод се користе у хемијској и фармацеутској индустрији.
Недавно је уместо хлора употребљен озон за цисту питку воду.
Биолошко деловање
Висока реактивност халогена објашњава чињеницу да су сва ова једињења отрови који имају загушљив ефекат и способни су да оштете органско ткиво. Упркос овим карактеристикама, ови елементи су неопходни за виталне процесе људског тела.
На пример, флуор је укључен у метаболичке процесе у нервним ћелијама, мишићима, жлездама. У свакодневном животу, тефлонска јела су све чешћа, флуор је једна од његових компоненти.
Хлор поспешује раст косе, стимулише метаболичке процесе, даје телесу снагу и снагу. Максимална количина у облику натријум хлорида је део крвне плазме. Међу једињењима овог елемента од посебног интереса са биолошког становишта је хлороводонична киселина.
Да је основа желучаног сока, укључен је у процесе цијепања хране. Да би тело функционисало нормално, особа мора да конзумира најмање двадесет грама дневно. сол.
Сви халогени су неопходни особи за виталну активност, а користе се иу различитим пољима активности.