Хемијске особине арена. Општа формула и карактеристике арене
Ароматски угљоводоници, који се називају и арени, представљају органске супстанце. Састав њихових молекула садржи једно или више бензенских језгара (прстенова). Бензен, који се назива и бензен, први је представник хомологне серије аренас. Хемијске особине, структура молекула и типови хемијских веза у њеном молекулу имају бројне карактеристике. Размотрићемо их у нашем чланку, као и упознати се са другим једињењима из групе ароматских угљоводоника.
Како успоставити структурну формулу арена
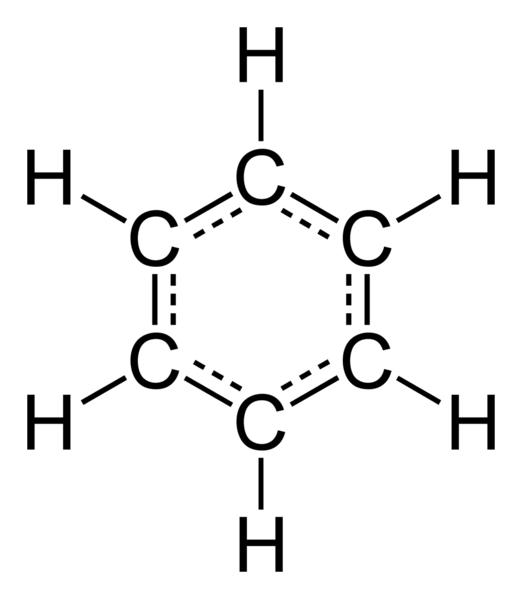
Године 1865. немачки научник Ф. Кекуле предложио је просторни модел најједноставније арене - бензена. Имао је облик равног шестерокута, на чијим су врховима били угљикови атоми, који су били спојени са три једноставне и двоструке везе, наизмјенично међусобно. Међутим, експериментално детектоване хемијске особине арена нису одговарале формули коју је предложио Ф. Кекуле. На пример, бензол не обезбоји раствор. калијум перманганат и бромовом водом, што указује на одсуство пи веза у молекулама арене. Каква је структура бензена у стварности? Ни појединачне ни двоструке везе ароматски угљоводоници не Експериментално је утврђено да ова једињења садрже између атома угљеника еквивалентан тип хемијске везе, названу сескуа или ароматична. Због тога не улазе у оксидациону реакцију са растворима КМнО4 и Бр2. Изводи се општа формула арена - ЦнХ2н-6. Сва специфична својства ароматичног једињења могу се објаснити њиховом електронском структуром, коју ћемо даље проучавати.
Електронска формула
Користећи бензен као пример, утврђујемо како су атоми угљеника међусобно повезани. Показало се да је свих шест атома угљеника у облику сп2 хибридизације. Угљеник је повезан са атомом водоника и два суседна атома угљеника помоћу три сигма везе. То је оно што формира равни шестоугаони облик молекула. Међутим, сваки атом угљеника још увек има још једну негативно набијену честицу која није укључена у хибридизацију. Његов електронски облак има облик бучице и налази се изнад и испод равни хексагона, названог бензенски прстен. Даље, свих шест бућица се преклапају и формирају заједничку ароматичну (једну и по) везу. Она одређује све физичке и хемијске карактеристике супстанци. То је електронска структура арена.

Шта је бензен?
Боље разумију карактеристике ароматичних угљоводоника помоћи ће познавање првог представника ове класе - бензена. Бензин је лако покретна, запаљива безбојна течност са осебујним мирисом, нерастворљивим у води. И једињење и његове паре су отровне. Према општој формули арена, квантитативни и квалитативни састав молекула супстанце може се изразити на следећи начин: Ц6Х6. Као и код других ароматских угљоводоника - толуен, антрацен или нафтален, за бензен ће бити типичне реакције сагоревања и супституције атома водоника бензенског језгра. Карактеристика тешке оксидације свих ароматичних једињења је веома димни пламен. Мешавина паре бензена са ваздухом је експлозивна, тако да се сви експерименти са супстанцом у лабораторији обављају само у дигестору. Бензен, као и друге ароматичне супстанце, не додаје воду или водоник халиде. Он такође не обезбоји раствор калијум перманганата и бромову воду. Хомолози бензена, као што су толуен или кумен, могу бити оксидовани, у ком случају не реагује сам бензенски прстен, већ само радикал.

Хемијске особине арена
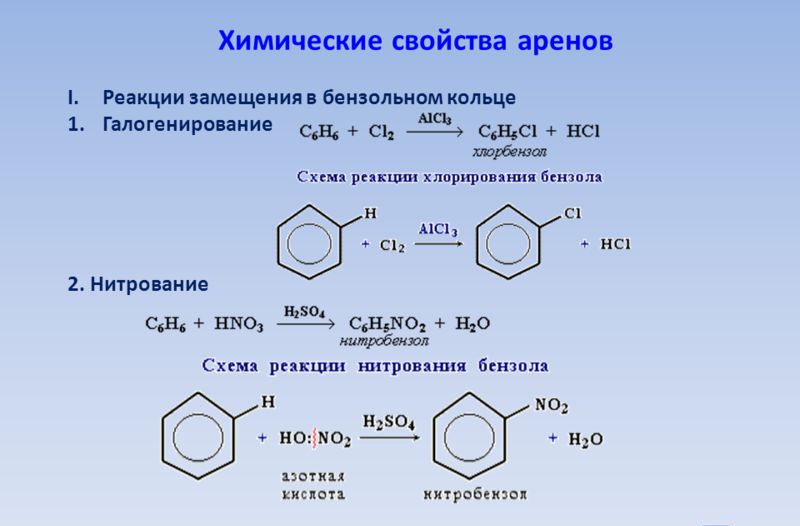
Какве су реакције способне за једињења која садрже бензенске прстене и једну и пол везу између атома угљеника? Као прво, то су реакције супституције, које су много лакше за њих него за алкане. Замислите евиденцију о каталитичкој реакцији између бензена и брома са учешћем фером бромида, што доводи до формирања бромобензена - безбојне течности нерастворљиве у води:
Ц6Х6 + Бр2 → Ц6Х5Бр + ХБр
Ако се алуминијум хлорид користи као катализатор у процесу, могуће је постићи потпуну супституцију свих атома водоника у молекулу бензена. У овом случају се формира хексаклоробензен, чији се безбојни кристали користе у методама заштите семена култивисаних биљака и обради дрвета ради продужења његовог рока трајања. За потпунији опис арена, додајте неке чињенице. Да би аромати додали друге супстанце, као што је хлор, потребни су посебни услови. У нашем случају то ће бити ултраљубичасто зрачење реакционе смеше. Производ реакције је хексаклороциклохексан, или, како се још назива, хексахлоран. Ово је добро познати алат у пољопривреди - инсектицид који се користи за борбу против инсеката инсеката.

Како и зашто добити нитробензен?
Настављамо преглед хемијских својстава арена. Користећи концентроване азотне и сулфатне киселине (нитратну смешу) у једној реакцији, могуће је добити производ важан за органску синтезу из бензен - нитробензена. То је бледо жута течност, масна по изгледу, са мирисом бадема. Не топива у води, али се често користи као растварач за многе органске супстанце: лакове, масти итд. Нитробензен је мулти-тонажни производ, јер се користи као сировина за производњу анилина. Ова супстанца је толико значајна за хемијску индустрију да је вредно размишљати о њој детаљније. Познати руски хемичар Н.Н. Зинин 1842 анилин је добијен из нитробензена реакцијом редукције амонијум сулфида. У савременим условима, контактни метод је постао широко распрострањен, при чему је мешавина водоника и нитробензен паре пропуштена на температури од 300 ° Ц изнад катализатора. Добијени ароматски амин се даље користи за производњу експлозива, бојила, лекова.
Од чега се производе ароматични производи?
Највише обећава да се добије производ из коксног угља иу процесу прераде. Циклопарафини садржани у угљеном катрану хидрогенирани су над катализатором на температурама до 300 ° Ц, продукт реакције је бензен. Дехидрогенација алкана такође доводи до стварања ароматичних угљоводоника. Реакција Зелински-Казан бензена се добија из етина проласком кроз тубу са активним угљем загрејаним на 600 ° Ц. Припрема арена, на пример толуена, изводи се коришћењем Фриедел-Црафтс реакције. Метилбензен (толуен) такође може бити миниран коришћењем хептана. Настали типови арена користе се као растварачи и адитиви за моторна горива, у производњи анилинске боје и отровне хемикалије.

Нафтален
50-70-тих година прошлог века нафталин је био једно од омиљених средстава за заштиту крзна и вунених производа од мољаца у свакодневном животу. Уз дуготрајну употребу, одећа је стекла карактеристичан, веома упоран мирис. Међутим, важнија је употреба нафталена као сировине за синтезу лијекова, бојила, експлозива. Главни начини његове производње заснивају се на преради нафтних деривата и отпада производње етилена - пиролизне смоле. Супстанца, за разлику од бензена, садржи два бензенска језгра, па се реакције нитрирања и халогенирања одвијају брже. Настављајући да дајемо примере арена, задржимо се на још једном важном ароматичном угљоводонику за индустрију - винил бензен.
Стирен
Савремена индустрија грађевинских материјала је немогућа без полимерних материјала: светла у обради, издржљива и отпорна на хабање. Полимери добијени од винил бензена, као што су полистирен (експандирани полистирен), САН и АБС пластика, користе се у производњи растезних плафона, подних облога, зидне изолације. Стирен се добија из етилбензена у облику безбојне, запаљиве течности са необичним мирисом. У будућности се подвргава полимеризацији и екстрахује чврсту стакласту масу - полистирен. Он служи као почетни производ у производњи горе поменутих грађевинских материјала. Винилбензен се користи као растварач, који се користи заједно са бутадиеном реакције полимеризације доводи до синтезе стирен-бутадиен гуме.

Номенклатура ароматских једињења
Назив арене према ИУПАЦ међународној класификацији укључује ознаку замјене, којој се додаје ријеч "бензен". На пример, Ц6Х5ЦХ3 је метилбензен, Ц6Х5Ц2Х3 је винилбензен. Ова једињења имају тривијална имена, тако да се прво једињење назива толуен, а друго - стирен. Арене могу да садрже два супституента, на пример, два метил радикала. Они су у стању да се придруже карбоксилном циклусу у три позиције: на 1 и 2 атома угљеника, онда говоре о орто позицијама супституената. Ако су радикали лоцирани на 1 и 3 честице угљеника, онда се ради о мета позиционирању супституената, на 1 и 4 атома угљеника, ово је пара супституција. Виши хомолози бензена могу бити представљени као деривати засићених угљоводоника, у молекулима од којих је један атом водоника замењен фенилним радикалом Ц6Х5-. На пример, једињење са формулом Ц6Х5Ц6Х13 ће се звати "фенилхексан".
У нашем чланку смо проучавали хемијске особине арена, а такође смо дали и опис њихових својстава и примене у индустрији.