Класификација термодинамичких система
Размотримо карактеристике термодинамичких система. Под њима се обично подразумевају физичке макроскопске форме, које се састоје од значајног броја честица, које нису намењене за описивање макроскопских параметара сваке појединачне честице.
Нема ограничења у природи материјалних честица које су интегралне компоненте таквих система. Они могу бити представљени у облику молекула, атома, јона, електрона, фотона.
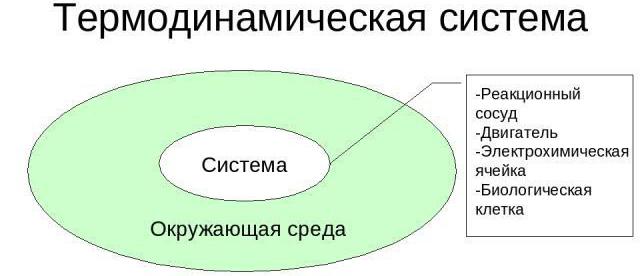
Посебне карактеристике
Анализирајмо карактеристичне карактеристике термодинамичких система. Као примјер, можете узети било који предмет који се може проматрати без употребе телескопа, микроскопа. Да би се дао потпуни опис таквог система, одабрани су макроскопски детаљи, захваљујући којима се могу одредити запремина, притисак, температура, електрична поларизација, магнетна индукција, хемијски састав и маса компоненти.
За било који термодинамички систем, постоје условне или стварне границе које их раздвајају од околине. Уместо тога, они често користе концепт термостата, који се одликује тако високом вредношћу топлотног капацитета да, у случају размене топлоте са анализираним системом, индекс температуре остаје константан.
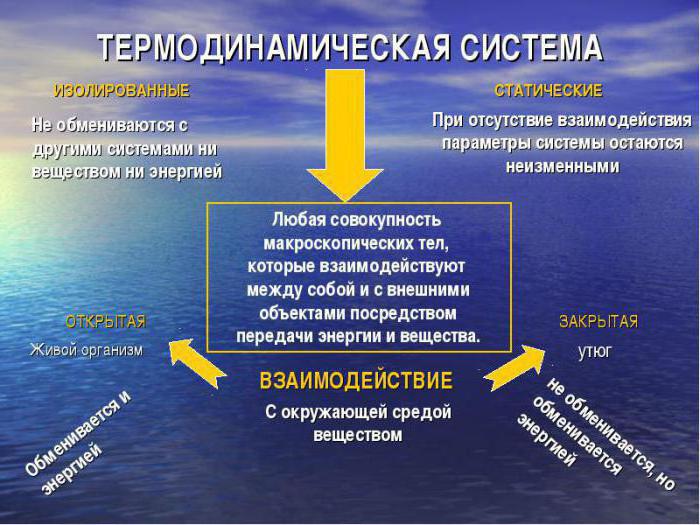
Класификација система
Размотрите шта чини класификацију термодинамичких система. У зависности од природе њене интеракције са окружењем, уобичајено је издвојити:
- изоловане врсте које не размењују материју или енергију са спољним окружењем;
- адијабатски изолована, а не размена супстанце са спољашњим окружењем, већ улазак у размену рада или енергије;
- затворени термодинамички системи немају размену супстанце, дозвољена је само промена у енергетској вредности;
- отворени системи се одликују потпуним преносом енергије, материје;
- дјеломично отворени могу имати полупропусне преграде, те стога не могу у потпуности судјеловати у размјени материјала.
У зависности од описа, параметри термодинамичког система могу се поделити на сложене и једноставне варијанте.

Карактеристике једноставних система
Једноставни системи се називају стања равнотеже, чије се физичко стање може одредити специфичном запремином, температуром, притиском. Примери термодинамичких система овог типа су изотропна тела која имају једнаке карактеристике у различитим правцима и тачкама. Дакле, течности, гасовите супстанце, чврсте материје, које су у стању термодинамичке равнотеже, нису изложене електромагнетним и гравитационим силама, површинској напетости, хемијским трансформацијама. Анализа једноставних тела препозната је у термодинамици као важна и релевантна са практичне и теоријске тачке гледишта.
Унутрашња енергија Термодинамички систем овог типа повезан је са околним светом. Када се описује употреба броја честица, маса супстанце сваке појединачне компоненте.
Комплексни системи
Комплекс укључује термодинамичке системе који не потпадају под једноставне облике. На пример, то су магнети, диелектрика, чврста еластична тела, суправодичи, површине интерфејса, топлотно зрачење, електрохемијски системи. Као параметри који се користе за њихово описивање, уочавамо еластичност опруге или шипке, површину фазног пресека, топлотно зрачење.
Физички систем се назива таквим скупом у којем нема хемијске интеракције између супстанци унутар граница температуре, притиска, одабраних за студију. И хемијски системи називају те опције које укључују интеракцију између његових појединачних компоненти.
Унутрашња енергија термодинамичког система зависи од присуства њене изолације са спољним светом. На пример, као варијанта адијабатске љуске, може се замислити Девар схип. Хомогени карактер се манифестује у систему у којем све компоненте имају слична својства. Примери за то су гасни, чврсти, течни раствори. Типичан пример хомогене гасне фазе је атмосфера Земље.
Карактеристике термодинамике
Овај део науке се бави проучавањем основних закона који регулишу процесе који су повезани са ослобађањем, апсорпцијом енергије. У хемијској термодинамици је намера да проучава међусобне трансформације саставних делова система, успостављајући законе који регулишу прелазак једне врсте енергије у другу под датим условима (притисак, температура, запремина).
Систем, који је предмет термодинамичких истраживања, може се представити као било који објект природе, који укључује велики број молекула који су међусобно одијељени са другим стварним објектима. Под стањем система подразумева се комбинација њених својстава, што омогућава да се одреди са становишта термодинамике.
Закључак
У сваком систему постоји прелазак једне врсте енергије у другу, и успоставља се термодинамичка равнотежа. Одсек за физику који су укључени у детаљну студију трансформација, промјена, очувања енергије, је од посебне важности. На пример, у хемијској кинетици могуће је не само описати стање система, већ и израчунати услове који су погодни за његово помјерање у правом смјеру.
Хесов закон, који повезује енталпију, ентропију разматране трансформације, омогућава да се идентификује могућност спонтане реакције, да се израчуна количина топлоте коју ослобађа (апсорбује) термодинамички систем.
Термокемија заснована на основама термодинамике је од практичног значаја. Захваљујући овом делу хемије, у производњи се спроводе прелиминарни прорачуни ефикасности горива и изводљивости увођења одређених технологија у стварну производњу. Информације добијене из термодинамике омогућавају примену феномена еластичности, термоелектричности, вискозности, магнетизације на индустријску производњу различитих материјала.