Калијум оксид: формула, интеракција
У неорганској хемији постоје три главне класе једињења. То су киселине, алкалије и оксиди. Киселина се састоји од катиона водоника и аниона киселинског остатка. Алкали су из металног катјона и хидроксилне групе. О оксидима ћемо разговарати детаљније у наставку.
Шта је оксид?
Ово једињење се састоји од два различита хемијска елемента, од којих је један кисеоник. Други може бити метални или неметални. Број атома кисеоника зависи од валенције другог хемијског елемента који је део једињења. На пример, валенција калијума је једнака једној, тако да ће калијум оксид садржати један атом кисеоника и два атома калијума. Валенција калцијума је два, тако да ће се његов оксид састојати од једног атома кисеоника и једног атома калцијума. Валенца фосфора је пет, тако да се њен оксид састоји од два атома фосфора и пет атома кисеоника.
У овом чланку ћемо више говорити о калијум оксиду. Наиме - о њеним физичким и хемијским својствима, о њеној примени у различитим индустријама. 
Калијум оксид: Формула
Пошто је валенција овог метала једна, а валенција кисеоника је два, ово хемијско једињење ће се састојати од два атома метала и једног атома кисеоника. Дакле, калијум оксид: формула - К 2 О. 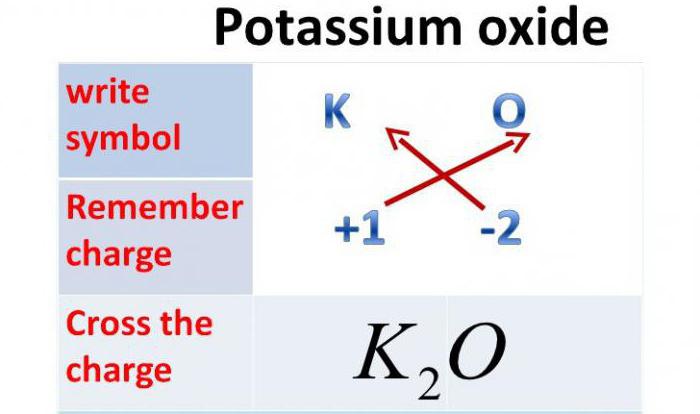
Пхисицал пропертиес
Разматрани оксид има бледо жуту боју. Понекад може бити безбојан. На собној температури, има чврсто агрегатно стање.
Тачка топљења ове супстанце је 740 степени Целзијуса.
Густина је 2,32 г / цм3.
Термичка декомпозиција овог оксида производи пероксид истог метала и чистог калијума.
Растворљив у органским растварачима.
Не раствара се у води, већ реагује с њом.
Веома је хигроскопан.
Хемијска својства К2О
Ова супстанца има хемијска својства карактеристична за све основне оксиде. Размотрите хемијске реакције овог оксида са различитим супстанцама по реду.
Реакција са водом
Пре свега, он је у стању да реагује са водом са формирањем хидроксида метала.
Једначина за ову реакцију је следећа:
- К 2 О + Х 2 О = 2КОН
Знајући моларну масу сваке од супстанци, следећи закључак се може извести из једначине: 112 грама калијум хидроксида се може добити из 94 грама дотичног оксида и 18 грама воде.
Са другим оксидима
Поред тога, оксид који се разматра може реаговати са угљен-диоксидом. (угљен диоксид). Ово формира со - калијум карбонат. 
Једначина за реакцију калијум оксида и угљендиоксида може се записати на следећи начин:
- К 2 О + ЦО 2 = К 2 ЦО 3
Дакле, може се закључити да је од 94 грама оксида у питању и 44 грама угљен диоксида, 138 грама. калијум карбонат.
Такође, разматрани оксид може реаговати са оксидом сумпора. Ово формира другу со - калијум сулфат.
Интеракција калијум оксида са сумпор оксидом може се изразити следећом једначином:
- К 2 О + СО 3 = К 2 СО 4
Показује се да се узимањем 94 грама дотичног оксида и 80 грама оксида сумпора може добити 174 грама калијум сулфата.
На исти начин, К2О може да реагује са другим оксидима.
Други тип интеракције су реакције не са киселим, већ са амфотерни оксиди. У овом случају, не формира се киселина, већ со. Пример таквог хемијског процеса је интеракција дотичног оксида са цинковим оксидом.
Ова реакција се може изразити следећом једначином:
- К 2 О + ЗнО = К 2 ЗнО 2
Показује се да се током интеракције оксида и цинковог оксида формира сол која се зове калијум-цинкат. Ако знате моларну масу свих супстанци, може се израчунати да од 94 грама К2О и 81 грама цинковог оксида можете добити 175 грама калијум-цинка.
Такође, К2О је у стању да интерагује са азотним оксидом. Ово формира мешавину две соли: нитрат и калијум нитрит. Једначина за ову реакцију изгледа овако:
- К 2 О + 2НО 2 = КНО 3 + КНО 2
Ако знате моларне масе супстанци, можемо рећи да од 94 грама дотичног оксида и 92 грама азотног оксида, може да се добије 101 грам нитрата и 85 грама нитрита. 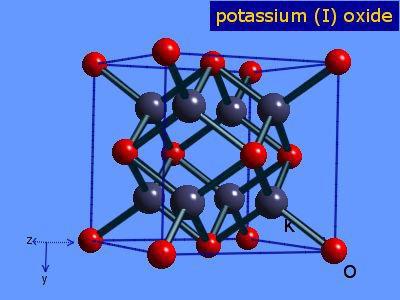
Интеракција са киселинама
Најчешћи случај је калијум оксид + сумпорна киселина = калијум сулфат + вода. Једначина реакције изгледа овако:
- К 2 О + Х 2 СО 4 = К 2 СО 4 + Х 2 О
Из једначине се може закључити да је за добијање 174 грама калијум сулфата и 18 грама воде потребно 94 грама оксида у питању и 98 грама сумпорне киселине.
Слично томе, хемијска интеракција се одвија између дотичног оксида и азотне киселине. Ово формира калијум нитрат и воду. Једначина за ову реакцију може се записати на следећи начин:
- 2К 2 О + 4ХНО 3 = 4КНО 3 + 2Н 2 О
Тако, од 188 грама дотичног оксида и 252 грама азотне киселине, може се добити 404 грама калијум нитрата и 36 грама воде.
По истом принципу, разматрани оксид може реаговати са другим киселинама. При томе се формирају друге соли и вода. Тако, на пример, у реакцији овог оксида са фосфорна киселина фосфати и вода се добијају, клоридна киселина и вода, са хлоридом и тако даље. 
К2О и халогени
Хемијски спој који се разматра може такође реаговати са супстанцама из ове групе. Халогени укључују једноставна једињења која се састоје од неколико атома истог хемијског елемента. Ово је, на пример, хлор, бром, јод и неке друге.
Дакле, хлор и калијум оксид: једначина:
- К 2 О + С 2 2 = КС + + КСОО
Као резултат ове интеракције настају две соли: калијум хлорид и хипохлорит. Од 94 грама дотичног оксида и 70 грама хлора, добијено је 74 грама калијум хлорида и 90 грама калијум хипохлорита.
Реакција амонијака
К2О је у стању да реагује са овом супстанцом. Као резултат ове хемијске интеракције, формирају се калијум хидроксид и амид. Једначина за ову реакцију је следећа:
- К 2 О + НХ 3 = КОХ + КНХ 2
Познавајући моларне масе свих супстанци, можемо израчунати пропорције реагенса и продуката реакције. Од 94 грама дотичног оксида и 17 грама амонијака, може се добити 56 грама калијум хидроксида и 55 грама калијум амида.
Интеракција са органским супстанцама
Од органских хемикалија, калијум оксид је у интеракцији са етрима и алкохолима. Међутим, ове реакције су споре и захтевају посебне услове.
Геттинг К 2 Абоут
Ова хемикалија се може добити на неколико начина. Ево најчешћих:
- Од калијум нитрата и металног калијума. Ова два реагенса се загревају, што доводи до формирања К2О и азота. Једначина реакције је следећа: 2КНО 3 + 10К = Н2 + 6К2О.
- Други метод се одвија у две фазе. Прво, долази до реакције између калијума и кисеоника, што доводи до стварања калијум пероксида. Једначина реакције изгледа овако: 2К + О 2 = К 2 О 2 . Даље, пероксид је обогаћен калијумом, због чега се добија калијум оксид. Једначина реакције се може записати на следећи начин: К 2 О 2 + 2 К = 2 К 2 О.

Употреба К 2 О у индустрији
Најчешће се сматра супстанца која се користи у пољопривредној индустрији. Овај оксид је једна од компоненти минералних ђубрива. Калијум је веома важан за биљке, јер повећава њихову отпорност на разне болести. Предметна супстанца се такође користи у грађевинарству, јер може бити присутна у саставу одређених врста цемента. Поред тога, користи се у хемијској индустрији за производњу других једињења калијума.