Најјача киселина. Формула најјаче киселине
О томе која је киселина најјача, расправљало се о више од једне генерације хемичара. У различито време, овај наслов је добио азот, сумпор, хлороводонична киселина. Неки су веровали да не може бити једињења јачег од флуороводичне киселине. Недавно су добијена нова једињења са јаким киселинским својствима. Можда је међу њима најјача киселина на свету? У овом чланку разматрају се карактеристике најјачих постојаних киселина нашег времена и дају се њихове кратке хемијске карактеристике.
Ацид цонцепт 
Хемија је егзактна квантитативна наука. И наслов "Најјача киселина" мора се разумно приписати једној или другој супстанци. Шта може бити главни индикатор који карактерише снагу било које везе?
Прво, сетимо се класичне дефиниције киселине. У основи, ова реч се користи за сложена хемијска једињења, која се састоје од водоника и киселинског остатка. Број атома водоника у једињењу зависи од валенције киселинског остатка. На пример, у молекулу хлороводоничне киселине постоји само један атом водоника; и сумпорна киселина већ има два Х + атома.
Ацид пропертиес
Све киселине имају одређене хемијске особине које се могу назвати заједничким за ову класу хемијских једињења.
- Способност интеракције са металима уз ослобађање водоника.
- Способност интеракције са базама, уз истицање соли.
- Могућност промене боје индикатора - на пример, да изазове црвенило лакмус папира.

У свим горе наведеним својствима испољава се још једна “вештина” било које познате киселине - способност да се даровати атом водоника, замењујући га атомом друге хемикалије или молекула једињења. Управо та способност карактерише “снагу” киселине и степен њене интеракције са другим хемијским елементима.
Вода и киселина
Присуство воде значајно смањује способност киселине да ослободи атоме водоника. То је зато што је водоник способан да формира своје хемијске везе између молекула киселине и воде, тако да је његова способност да се одвоји од базе мања од способности неразријеђених киселина.
Суперацид
Реч "суперкиселина" уведена је у хемијски речник 1927. године, са светлом руком чувеног хемичара Џејмса Конанта.
Стандард јачине овог хемијског једињења је концентрована сумпорна киселина. Хемијска супстанца или било која мешавина која прелази киселост концентрисане сумпорне киселине назива се суперкиселина. Вредност суперкиселине је одређена њеном способношћу да даје позитивно електрични набој из било којег разлога. За основни параметар за одређивање киселости усвојен је одговарајући индикатор Х 2 СО 4 . Међу јаким киселинама постоје супстанце са прилично необичним именима и својствима.
Познате јаке киселине
Најпознатије киселине из процеса неорганске хемије су хидројодичне (ХИ), бромоводичне (ХБр), хлороводоничне (ХЦл), сумпорне (Х2С04) и нитратне (ХНО3) киселине. Сви они имају висок индекс киселости и могу да реагују са већином метала и база. У овој серији, најјача киселина је мешавина азотне и хлороводоничне киселине, назване "акуа региа". Формула најјаче киселине ове серије је ХНО3 + 3 ХЦл. Ово једињење је способно да раствори чак и племените метале као што су злато и платина.

Чудно је да флуороводична киселина, која је једињење водоника са најјачим халогеном - флуором, није ушла у кандидате за титулу "Најјача киселина у хемији". Једина карактеристика ове супстанце је способност растварања стакла. Према томе, таква киселина се складишти у полиетиленској посуди.
Јаке органске киселине
Кандидати за титулу "Најјача киселина у органској хемији" - мравља и сирћетна киселина. Мравља киселина је најјачи у хомологном опсегу ограничавајућих киселина. Име је добила због чињенице да се дио налази у излучевинама мрава.

Сирћетна киселина је мало слабија од мравље киселине, али је њен спектар расподеле много шири. Често се налази у соковима биљака и формира се током оксидације различитих органских материја.
Најновија дешавања у области хемије омогућила су синтезу нове супстанце која може конкурирати традиционалним органским супстанцама. Трифлуорометансулфонска киселина има индекс киселости већи од сумпорне киселине. У исто време, ЦФ3СО3Х је стабилна хигроскопна течност са утврђеним физичко-хемијским својствима у нормалним условима. Данас се овом једињењу може доделити назив „Најјача органска киселина“.
Многи могу помислити да степен киселости не може бити значајно виши од брзине сумпорне киселине. Али недавно, научници су синтетисали низ супстанци чији су параметри киселости неколико хиљада пута већи од вредности сумпорне киселине. Једињења добијена интеракцијом протонске киселине са Левис-овом киселином имају абнормално високе вредности киселости. У научном свету се називају: сложене протонске киселине.
Магична киселина
Да У реду Магицал ацид. То се зове. Магична киселина је мешавина водоник флуорида или флуор сулфонске киселине са антимон пентафлуоридом. Хемијска формула овог једињења је приказана на слици: 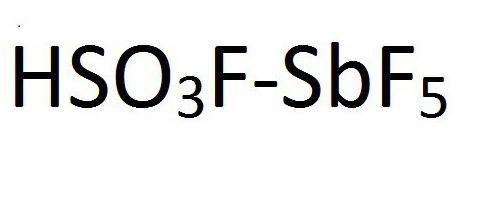
Ово чудно име магичне киселине примљено је на божићној забави хемичара, која се догодила раних 1960-их. Члан истраживачког тима, Ј. Олаха, показао је смешан трик, растварајући воштану свећу у овој невероватној течности. Ово је једна од најјачих киселина нове генерације, али је већ синтетисана супстанца која га надмашује у снази и киселости.
Најјача киселина на свету
Карборска киселина је карборанска киселина, која је далеко најјача једињења на свету. Формула најјаче киселине изгледа овако: Х (ЦХБ11Цл11).
Ово чудовиште је настало 2005. године на Калифорнијском универзитету, у блиској сарадњи са Новосибирским институтом за катализу СБ РАС.
Сама идеја синтезе настала је у умовима научника, заједно са сном о новим, нечувеним молекулима и атомима. Нова киселина је милион пута јача од сумпорне, док је потпуно неагресивна, а најјача киселина се лако може ускладиштити у стакленој бочици. Међутим, временом се стакло још увек раствара, а са повећањем температуре брзина ове реакције се значајно повећава. 
Ова невероватна мекоћа је резултат високе стабилности новог једињења. Као и све хемикалије повезане са киселинама, карборанска киселина брзо реагује, одбацујући свој једини протон. База киселине је тако стабилна да хемијска реакција не иде даље.
Хемијска својства карборанске киселине
Нова киселина је одличан протон донор Х + . То је оно што одређује снагу ове супстанце. Раствор карборанске киселине садржи више јона водоника него било која друга киселина на свету. У хемијској реакцији СбФ 5 - антимон пентафлуорид, везује јон флуора. Истовремено се ослобађају нови и нови атоми водоника. Зато је карборанска киселина најјача на свету - суспензија протона у њеном раствору је 2 × 10 19 пута већа од сумпорне киселине.
Међутим, кисела база овог једињења је изузетно стабилна. Молекул ове супстанце састоји се од једанаест атома брома и истог броја атома хлора. У свемиру, ове честице формирају сложену, геометријски правилну фигуру, која се назива икосахедрон. Овај распоред атома је најстабилнији, што објашњава стабилност карборанске киселине. 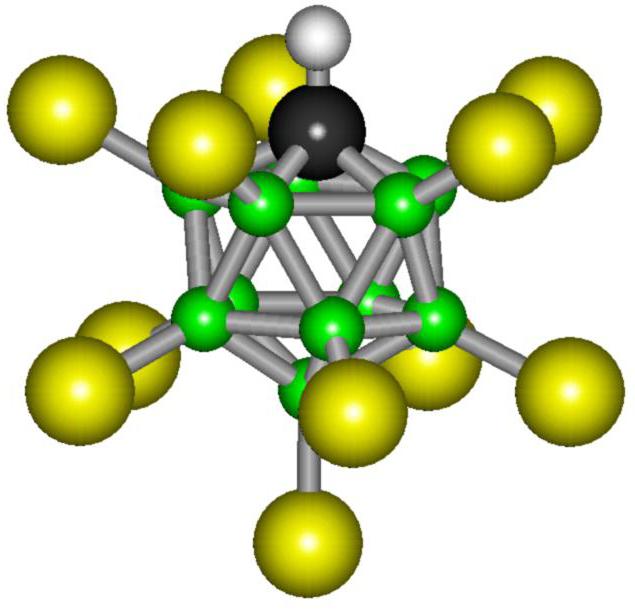
Вредност карборанске киселине
Најјача киселина на свету донела је својим творцима заслужене награде и признања у научном свету. Иако сва својства нове супстанце нису потпуно разумљива, већ постаје јасно да значај овог открића превазилази лабораторије и истраживачке институте. Карборанска киселина се може користити као снажан катализатор у различитим индустријским реакцијама. Поред тога, нова киселина може да реагује са најтврдокорнијим хемикалијама - инертним гасовима. Тренутно је у току рад, омогућујући могућност уласка у реакцију ксенона.
Несумњиво, задивљујућа својства нових киселина наћи ће своју примену у различитим областима науке и технологије.