Структура гасовитих, течних и чврстих тела је кратка
Под одређеним условима, сва материја на планети Земљи је присутна у једном од три стања: гасовитом, течном или чврстом. Постоји и четврто стање материје, названо плазма. Размотримо питање структуре гасовитих, течних и чврстих тела, као и њихов прелазак из једног стања у друго када се промене спољни услови.
Чврсто стање материје
Чврсте материје се одликују способношћу да се одупру спољашњим силама које утичу на њих да би промениле свој облик и запремину. Узимајући у обзир структуру гасовитих, течних и чврстих тела и задржавајући се на њима, мора се рећи да су молекули у њима чврсто повезани. Дакле, објекат има специфичну форму коју чува под истим вањским увјетима.
Молекули у чврстом стању могу бити у уређеном стању, онда говоре о кристалној структури. Или су можда у поремећеном стању, онда говоримо о аморфним чврстим материјама. Изузетан пример цристал латтице је структура металних система, која у простору формира идеалну решетку одређеног типа, у чијим чворовима постоје јони атома. Пример чврстог објекта са аморфном структуром је стакло.

Наука о чврстој материји
Солидне студије неколико наука, које укључују следеће:
- Физика кондензоване материје. Проучава чврсте и течне материје, чије димензије прелазе 10 19 честица, користећи експерименталне и теоријске методе.
- Механика деформација. Ова наука проучава механичка својства чврстих материја као што су напони у њима, еластичне и пластичне деформације, као и повезивање ових својстава са термодинамичким спољним параметрима. У овој дисциплини структура најтеже супстанце је неважна.
- Наука о материјалима. Већ проучава структуру молекула чврстих, течних и гасовитих тела, као и фазне прелазе између ових стања.
- Хемија чврстог стања. Ова дисциплина је специјализована за синтезу нових материјала у чврстом стању.
Нека својства чврстих материја
При константном притиску и релативно ниским температурама, супстанца је у чврстом стању. Ефекат мале спољашње силе на чврсто стање не доводи до спољашње видљиве деформације чврстог материјала.
Ако повећате силу, тело ће се почети еластично деформисати. Са још већим повећањем екстерне изложености, могуће су две опције:
- Ако је тело метал, он ће почети да доживљава пластичну деформацију, односно да ће доћи до значајних промена у њеном облику, који ће остати након престанка спољашњег утицаја.
- Ако тело има аморфну структуру или кристалну структуру, али у местима решетке ће бити јона различитих знакова, на пример, кристал соли НаЦл, онда се тело неће деформисати пластично, већ ће се једноставно срушити.
Свако чврсто тело карактерише одређена густина. Најлакша супстанца у овој категорији је аерогел, а његова густина је 3 кг / м 3 . Али најчвршћи материјал познат човечанству је метал - осмијум. Један метар кубни осмијум има масу од 22.600 кг.
Метални материјали
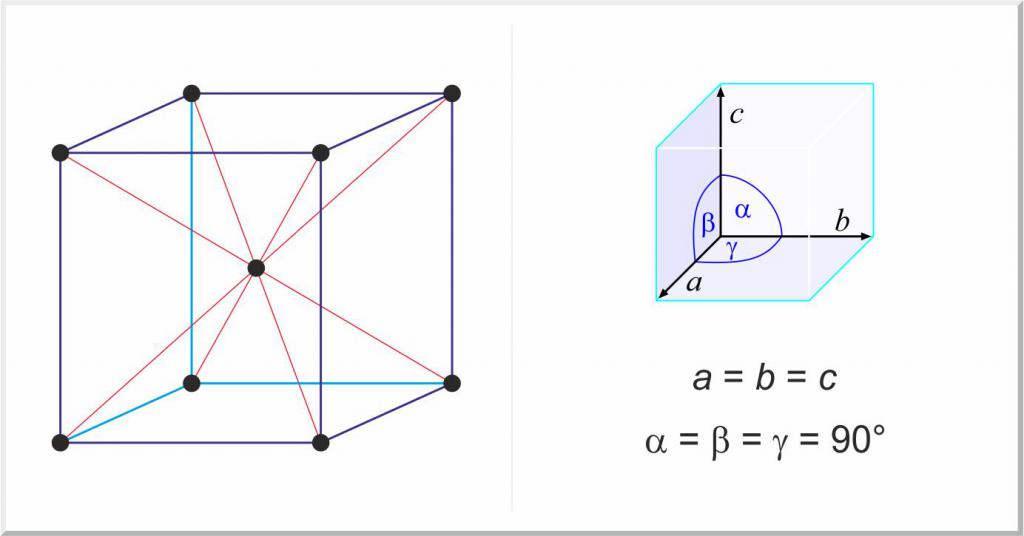
Посебна група чврстих материја су чисти метали и њихове легуре. У овом случају, разлика у структури чврстих материја из гасовитог и течног стања материје састоји се у постојању просторне периодичне решетке, која се назива кристална решетка.

Због њихове кристалне структуре, метали имају бројна важна својства, на примјер, пластичност и дифракцију. Скоро све постоје у три главне кристалне решетке:
- кубни центар центриран, нпр. Ау, Аг, Ал, Цу;
- кубични центрирани, на пример Нб, Мо, В, Фе;
- Шестоугаони чврсто упаковани, на пример, Ти, Зр.
Наука о кристалографији је развијена за проучавање особина кристалних решетки.
Кондензована материја - течност
Течно стање као и чврсто стање је нестисљиво, тј. Задржава своју запремину у великом опсегу притисака. Међутим, течност не задржава свој облик, што га разликује од чврстог материјала и приближава га гасном стању материје.

Ако молекуларне и атомске силе делују у формирању чврстих материја, онда се течност формира молекулима који су међусобно повезани само молекуларним слабим силама. Најчешћа на Земљи је вода, која, попут гаса, може бити у облику посуде у коју је смјештена.
Ако говоримо о структури гасовитих, течних и чврстих тела, треба напоменути да течност, за разлику од гаса, не мења своју густину када се стави у затворену посуду.
Специфичне особине флуида
За сваку течност, због присуства молекуларних сила у њој, својства као што су површинска напетост и капиларни ефекат су својствена. Ако је супстанца у пољу гравитације, на пример, наше Земље, онда ће било које тело смештено у њу бити избачено из течности према чувеном Архимедовом закону.

Ако гравитација не делује на течност, онда ће плутајућа сила бити нула. Поред тога, у одсуству спољашњих сила супстанци у таквом стању настоји да стекне најмању површину, чиме се смањује укупна енергија. Због тога, у условима бестежинског стања, водене капљице имају сферични облик, јер је лопта фигура са најмањом површином за ову запремину течности.
Капиларне особине се објашњавају способношћу молекула да уђу у односе не само међусобно, већ и са атомима и молекулима других тела. Ове физичке карактеристике флуида називају се кохезија и адхезија.
Говорећи укратко о структури гасовитих, течних и чврстих тела, треба поменути својство вискозности, које је својствено текућем и гасовитом стању. Вискозност је способност да се одупре било каквом померању слојева супстанце један у односу на други у присуству градијента притиска. За течности овај индикатор зависи од брзине померања ових слојева, температуре и молекулске тежине. Што је већа брзина тела у флуиду, већа је молекулска тежина честица течности и што је температура нижа, то је већа вискозност.
Структура гаса
Гас је стање материје, када његове конститутивне честице нису повезане ни са једном силом или су те силе веома слабе. Дакле, такве супстанце слободно мењају волумен и облик, попуњавајући целу посуду у којој се налазе. Ова разлика у структури гасовитих тела од течног и чврстог доводи до чињенице да имају мању густину. У случају гасне воде, уобичајено је говорити о пари.

Не постоји апсолутни поремећај у стварним гасовима. Међутим, молекули у њему се крећу тако брзо да практично не комуницирају једни с другима. Дакле, гас испуњава апсолутно било који волумен, а молекули у њему ће бити одвојени релативно великим удаљеностима у односу на величину самих молекула. Због велике удаљености између молекула, гасови се лако компримирају, а повећавају њихову густину и унутрашњи притисак.
Перфецт гас
У физици, кроз стварање модела структуре чврстих, течних и гасовитих тела, јављају се разумна поједностављења реалних стања материје, која омогућавају коришћење једноставнијег математичког апарата за проучавање ових стања. Један такав модел био је концепт идеалног гаса.
Овај термин се односи на гасовито стање супстанце у којој молекули имају тачкасте величине у поређењу са растојањима између њих, и у којима не интерагују једни са другима.
У нормалним условима, то јест, при атмосферском притиску и собној температури, већина реалних гасова може се сматрати идеалним. На пример, азот, кисеоник, водоник, племенити гасови, угљен диоксид и други.
Једначина стања за идеалан гас је следећа:
П * В = н * Р * Т, где:
П, В, Т и н - притисак, запремина, температура и количина гасне супстанце
Р = 8,31 Ј / (мол * К) је универзална константа.
Плазма је четврто стање материје
Када се разматра структура гасовитих, течних и чврстих тела у 10. разреду, они такође обраћају пажњу на друго стање материје - плазму, која је гас који се састоји од катјона и аниона, односно позитивно и негативно набијених честица. Главни пример плазме је супстанца која чини наше Сунце.
За више својстава, плазма је слична гасу, једина разлика је у томе што је способна да реагује на магнетна поља, као и да проводи електричну струју. Плазма се може добити загревањем гаса до високих температура, јер ће то изазвати сударе између молекула, што доводи до њихове делимичне или потпуне јонизације.
Промена стања материје
У физици класе 10, структура гасовитих, чврстих и течних тела се разматра заједно са прелазима између ових стања. Прелази између стања супстанци могући су због промена притиска и температуре. Промене се јављају само у физичкој структури гасовитих, течних и чврстих тела, а њихов хемијски састав остаје константан.
Могући су следећи прелази између различитих стања материје:
- Мелтинг Ендотермички процес преласка из чврстог у течни.
- Кристализација. Егзотермни процес у којем течност постаје чврста током хлађења.
- Боил. Физички ендотермички процес у коме течност улази у гас.
- Кондензација Егзотермни прелаз гаса у течност.
- Сублимација или сублимација. Ендотермички прелаз из чврстог у гас, заобилазећи течно стање. Класичан пример је сублимација сувог леда.
Треба напоменути да сви ендотермни и егзотермни процеси фазних прелаза настављају са константном температуром супстанце. Сви ови процеси, чије је постојање због специфичности структуре гасовитих, течних и чврстих тела, енергетски, односно захтевају или снабдевање или уклањање енергије током њихове примене.